| 🎓 Заказ №: 22216 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
В объеме воды V(H2O) растворили массу вещества m. Плотность полученного раствора ρ. а) найдите массовую долю вещества в растворе, молярную и нормальную концентрации и титр полученного раствора;
Решение: а) Массовая доля растворенного вещества равна отношению массы растворенного вещества к массе раствора. ( ) ( ) 100 % ( ) m р ра HCl m HCl HCl Масса раствора равна сумме масс растворенного вещества и растворителя. ( ) ( ) ( ) m р ра HCl m HCl m H2O Масса жидкости равна произведению объема жидкости на её плотность. ( ) ( ) ( ) m H2O V H2O H2O Принимаем плотность воды 1 г/мл. Находим массу раствора m( р ра HCl) m(HCl) V(H O) (H O) 36,5 250 1 286,5 г 2 2 Находим массовую долю хлороводородной кислоты в растворе 12,74 % 286,5 36,5 100 ( ) ( ) 100 % ( ) m р ра HCl m H Молярная концентрация растворенного вещества равна отношению количества растворенного вещества к объему раствора. ( ) ( ) ( ) V р ра HCl n HCl С HCl М Количество вещества равно отношению массы вещества к молярной массе вещества. ( ) ( ) ( ) M HCl m HCl n HCl Объем раствора равен отношению массы раствора к его плотности. мл л р ра HCl m р ра HCl V р ра HCl 269 0,269 1,065 286,5 ( ) ( ) ( ) Находим молярную концентрацию хлороводородной кислоты


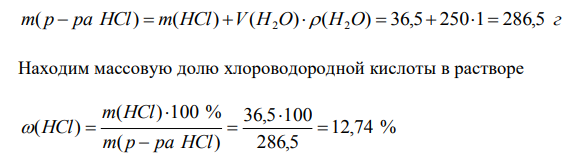


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции.
- Напишите уравнения диссоциации двух данных веществ. Рассчитайте рН водных растворов обоих веществ с указанной концентрацией (константа диссоциации слабого электролита приведена в задании).
- Напишите графические формулы данных веществ, их названия и укажите классы соединений, к которым они относятся. HF, P2O5, Al(OH)3, CaSO4
- Окислительно-восстановительные реакции протекают по приведенным схемам. Схемы реакций 123 Ge + KOH + O2 → K2GеО3 + H2O HCl + CrO3 → Cl2 + CrCl3 + H2O
- Пользуясь таблицей стандартных электродных потенциалов, составьте схему гальванического элемента, состоящего из двух данных металлов, погруженных в растворы их солей с концентрацией 1М.
- Определите временную, постоянную и общую жесткость природной воды, в 1 м3 которой содержится данная масса следующих солей. 100 г Ca(HCO3)2, 300 г Mg(HCO3)2, 200 г Na2SO4
- Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в водных растворах между веществами: а) AgCl и K2S; б) Fe(OH)2 и HCl; в) CaCO3 и HNO3.
- На растворение 2,43 г металла было израсходовано 7,3 г хлороводородной кислоты. Рассчитайте эквивалент металла и определите, какой металл участвовал в реакции.
- Для данной соли напишите уравнения гидролиза по первой ступени в молекулярной форме, полной и краткой ионной форме, определите тип гидролиза, рассчитайте константу гидролиза, степень гидролиза и рН раствора этой соли.
- Определить молярную концентрацию вещества, степень диссоциации (α) или константу диссоциации KД первой ступени: HCIO
