| 🎓 Заказ №: 22199 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
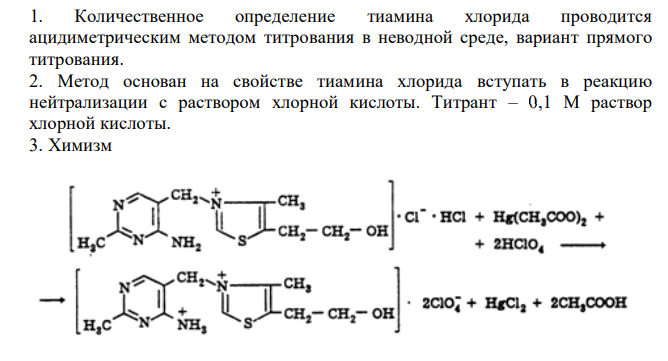
Дайте заключение о качестве тиамина хлорида по количественному определению с учетом требований ФС.2.1.0188.18(должно быть тиамина хлорида не менее 98,5 % и не более 101,0 % в пересчете на безводное и свободное от остаточных органических растворителей вещество), если на его навеску, равную 0,1492 г израсходовалось 8,70 мл 0,1 М раствора хлорной кислоты с К = 0,9985. Потеря в массе при высушивании составила 3,0 %, содержание остаточных органических растворителей 0,02% (М.м. тиаминахлорида 337,27). На контрольный опыт израсходовано 0,06 мл титранта. Приведите обоснование метода и соответствующие уравнения реакций.
Решение: 1. Количественное определение тиамина хлорида проводится ацидиметрическим методом титрования в неводной среде, вариант прямого титрования. 2. Метод основан на свойстве тиамина хлорида вступать в реакцию нейтрализации с раствором хлорной кислоты. Титрант – 0,1 М раствор хлорной кислоты. 3. Химизм

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Имеется раствор соли (см. вариант в табл. 7). 159 1. Напишите ионно-молекулярное и молекулярное уравнения реакции гидролиза и выражение для константы гидролиза данной соли по первой ступени (Kг1).
- Приведите расчет интервала навески соли (М.м. натрия гидрокарбоната 84,01) исходя из чувствительности иона (И.м. иона натрия 22,99) для доказательства подлинности натрия гилрокарбоната по катиону натрия по методике А (Приложение № 2).
- Сколько воды необходимо к 100 мл 20% (масс.) раствора хлороводородной кислоты с плотностью 1,10 г/мл, что бы получить 5% (масс.) раствор?
- Дайте обоснование определению примеси хлоридов в воде для инъекций ФС.2.2.0019.18 (Приложение № 3).
- Назвать вещества и указать класс соединений: CH3 – COOH, С2H5 – O – C2H5, СH4, СH2=CH – Cl
- 200 г неизвестного вещества прокалили с углем.
- Определите энергию перехода электрона в атоме водорода, которой соответствует красная линия спектра испускания (l = 656 нм).
- Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций и укажите направление смещения равновесия при изменении условий.
- Массовая доля железа в хлориде составляет 0,3446.
- Восстановление оксида железа (III) водородом до свободного металла по уравнению Fe2O3(к)+ 3Н2(г) = 2Fe(к) + 3Н2О(г) сопровождается поглощением 96,2 кДж теплоты.
