| 🎓 Заказ №: 22215 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Дайте заключение о качестве фенола (М.м. 94,11) по количественному содержанию с учётом требования ФС.2.1.0042.15 (фенола должно быть не менее 99,0 % в пересчете на безводное вещество), если навеску 2,0120 г растворили в мерной колбе вместимостью 1,0 л, прибавили 50,0 мл 0,0167 М раствора калия бромата. На титрование 25,0 мл полученного раствора израсходовалось 26 18,00 мл 0,1 М раствора натрия тиосульфата (К = 0,9978). На контрольный опыт израсходовалось 49,90 мл титранта. Содержание воды – 0,4 %.
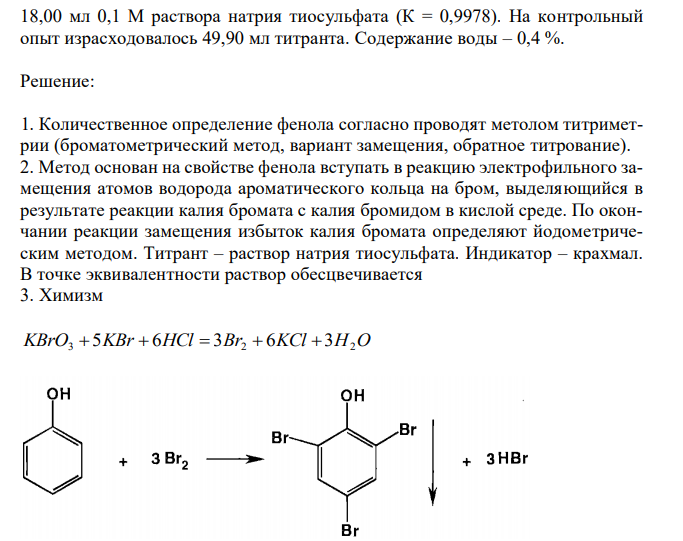
Решение 1. Количественное определение фенола согласно проводят метолом титриметрии (броматометрический метод, вариант замещения, обратное титрование). 2. Метод основан на свойстве фенола вступать в реакцию электрофильного замещения атомов водорода ароматического кольца на бром, выделяющийся в результате реакции калия бромата с калия бромидом в кислой среде. По окончании реакции замещения избыток калия бромата определяют йодометрическим методом. Титрант – раствор натрия тиосульфата. Индикатор – крахмал. В точке эквивалентности раствор обесцвечивается 3. Химизм KBrO3 5KBr 6HCl 3Br2 6KCl 3H2O

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Найдите объем кислорода (н.у.), который выделится при пропускании тока силой 6 А в течение 40 мин через водный раствор гидроксида калия.
- Чему равен температурный коэффициент реакции, если при увеличении температуры на 100 °С скорость реакции возрастает в 10 раз?
- Составьте координационные формулы семи комплексных соединений, которые можно получить из сочетания частиц Со3+ ; NH3; NO2 – ; K+ (координационное число кобальта равно 6).
- Запишите формулы химических соединений. Укажите, к какому классу они относятся. Na+NxO –2 y; C +4 xOy; K + x(PO4) –3 y; Mg+2 x(OH) –1 y; HxC +4Oy
- Константа равновесия системы N2(г) + 3 H2(г) ⇄ 2 NH3(г) при 400 ºС равна 0,1. Равновесные концентрации (моль/л): [H2] = 0,2; [NH3] = 0,08. Вычислить равновесную и исходную концентрации азота.
- При электролизе раствора сульфата никеля выделяется 4,2 л. кислорода (н.у.). Сколько граммов никеля выделится на катоде?
- На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению С2Н4(г) + 3О2(г) = 2СО2 (г) + 2Н2О(ж).
- Как называют полимер состава
- Составьте схему гальванического элемента, состоящего из двух алюминиевых пластинок, опущенных в растворы его соли с концентрацией [Al3+] = 1 моль/л у одного электрода и [Al3+ ] = 0,1 моль/л у другого электрода. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
- На р-подуровне находятся 3 электрона. Как они располагаются на р-орбиталях в нормальном состоянии?
