| 🎓 Заказ №: 22207 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Дайте обоснование комплексонометрическому методу количественного определения магния сульфата (ГФ X, ст. 383). Напишите химизм реакций, рассчитайте титр анализируемого вещества по 0,05 М титрованному раствору. Методика: около 0,15 г препарата (точная навеска) растворяют в 50 мл воды, прибавляют 5 мл аммиачного буферного раствора и титруют при энергичном перемешивании 0,05 М раствором натрия эдетата до синего окрашивания (индикатор – кислотный хром черный специальный). Параллельно проводят контрольный опыт. Содержание магния сульфата в субстанции должно быть не менее 99,0 % и не более 102,0 %. М.м. сульфата магния гептагидрата 246,48.
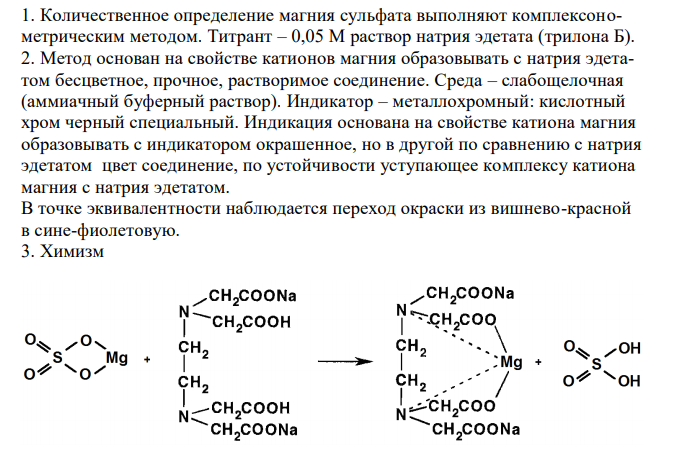
Решение: 1. Количественное определение магния сульфата выполняют комплексонометрическим методом. Титрант – 0,05 М раствор натрия эдетата (трилона Б). 2. Метод основан на свойстве катионов магния образовывать с натрия эдетатом беcцветное, прочное, растворимое соединение. Среда – слабощелочная (аммиачный буферный раствор). Индикатор – металлохромный: кислотный хром черный специальный. Индикация основана на свойстве катиона магния образовывать с индикатором окрашенное, но в другой по сравнению с натрия эдетатом цвет соединение, по устойчивости уступающее комплексу катиона магния с натрия эдетатом. В точке эквивалентности наблюдается переход окраски из вишнево-красной в сине-фиолетовую. 3. Химизм

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Температурный коэффициент некоторой реакции γ=3,3.
- Осуществить цепочку превращений Na2S → H2S → SO2 → KHSO3
- Какая масса раствора с массовой долей NaOH 2% необходима для получения 63,3 л дифторида кислорода?
- Как можно получить озон из кислорода? Какова объемная доля (%) озона в озонированном кислороде, если после разложения озона объем озонированного кислорода увеличился на 5 % ?
- Как изменится скорость реакции 2CuO(к) + 4NO2(г) + O2(г) = 2Cu(NO3)2(к) если давление на систему увеличить в 3 раза?
- При каких условиях температуры и давления возрастет скорость прямой реакции в системе 2SnO(к) + O2(г) ↔ 2SnO2(к), ΔH°= -589 кДж/моль?
- В системе 3C2H4(г) ↔ C6H6(г) + 3H2(г) равновесные концентрации веществ равны: [C2H4] = 0,4 моль/л; [C6H6] = 0,2 моль/л; [H2] = 0,6 моль/л.
- Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 29.
- Какими химическими свойствами обладает озон? Закончите уравнения реакций: а) … Ag O3 ; б) … Na2 S O3 ; в) … KI O3 H2O
- Сделайте предварительный расчет объема 0,1 М раствора серебра нитрата, который должен израсходоваться при количественном определении субстанции калия йодида по методике ГФ XII, ч. 3, ФС 42– (см. приложение, с. 59).
