| 🎓 Заказ №: 22189 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Дайте обоснованный ответ, в каком направлении может самопроизвольно протекать заданная реакция? Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1 л моль .
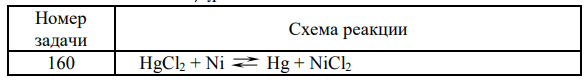
Решение: Окислительно-восстановительная реакция может протекать в прямом направлении в том случае, если электродный потенциал окислительной системы больше потенциала восстановительной системы. Стандартные электродные потенциалы двух имеющихся систем имеют следующие значения Первая система является окислительной, вторая восстановительной. Таким образом, никель является анодом, ртуть – катодом. Схема гальванического элемента

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций Cr2(SO4)3 + Br2 + KOH K2CrO4 + KBr + K2SO4 + H2O
- Составьте ионное и молекулярное уравнение реакции гидролиза соли NaCN, выражение для константы гидролиза и оцените величину рН раствора.
- Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 56Ba 6C 24Cr
- Напишите процессы, протекающие у электродов при электролизе водных растворов веществ: Na2SO4; NiSO4; KBr; CuI2.
- Цинк склепан с кадмием. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду?
- Определить, в каком соединении более прочная связь бромид олова или бромид углерода?
- Напишите электронную формулу невозбужденного атома элемента с зарядом ядра z, приведите графическую схему распределения электронов по квантовым ячейкам (орбиталям). z= 39
- Рассчитайте ЭДС гальванического элемента, составленного из двух кадмиевых электродов, погруженных в раствор с концентрацией: с1 = 0,01 150 моль/л и с2 = 0,1 моль/л CdSO4.
- При восстановлении 1,2 г оксида металла водородом образовалось 0,27 г воды.
- Характеристика состояния электронов в атоме системой квантовых чисел.
