| 🎓 Заказ №: 22183 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
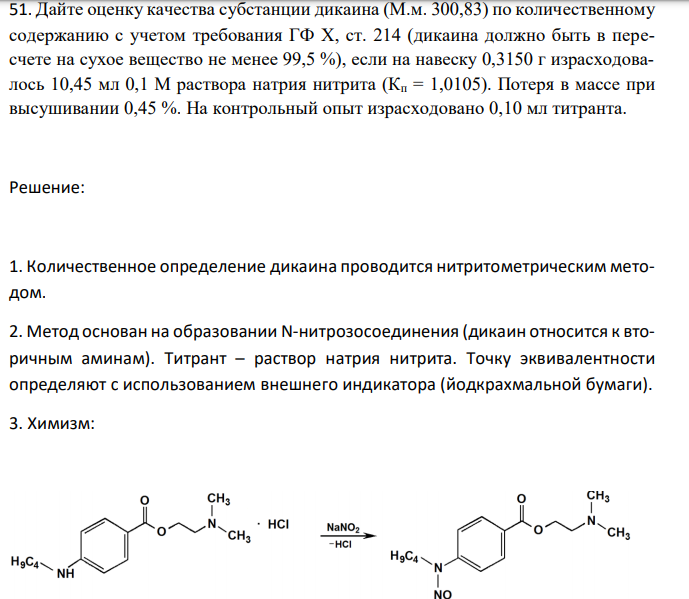
Дайте оценку качества субстанции дикаина (М.м. 300,83) по количественному содержанию с учетом требования ГФ X, ст. 214 (дикаина должно быть в пересчете на сухое вещество не менее 99,5 %), если на навеску 0,3150 г израсходовалось 10,45 мл 0,1 М раствора натрия нитрита (Кп = 1,0105). Потеря в массе при высушивании 0,45 %. На контрольный опыт израсходовано 0,10 мл титранта.
Решение: 1. Количественное определение дикаина проводится нитритометрическим методом. 2. Метод основан на образовании N-нитрозосоединения (дикаин относится к вторичным аминам). Титрант – раствор натрия нитрита. Точку эквивалентности определяют с использованием внешнего индикатора (йодкрахмальной бумаги). 3. Химизм: 2NaNO2 4HCl 2KI I 2 2NO 2NaCl 2KCl 2H2O 4. Фактор эквивалентности f экв 1 5. Молярная масса эквивалентности Э f М м г моль экв . 1272,78 272,78 / 6. Находим титр раствора натрия нитрита по дикаину г мл Э M T 0,03008 / 1000 300,83 0,1 1000 7. Расчет процентного содержания дикаина в субстанции (100 ) ( 100 100 . .) a b Т V V K С к о п где: С найденное содержание дикаина, %; V объем раствора натрия нитрита, израсходованный на титрование, мл; Vк.о. объем раствора натрия нитрита, израсходованный на контрольный опыт, мл; Kп коэффициент поправки к концентрации раствора натрия нитрита;


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe(OH)3 + 3H+ = Fe3+ + 3H2O б) Cо 2+ + 2OH- = Cо(OH)2 в) H+ + NO2 — = HNO2
- На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: S H2 SO4(конц.) SO2 H2O
- При 25 ºС растворимость NaCl равна 36,0 г в 100 г воды.
- Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FеСl3 и NН4ОН; в) CH3COONa и HCl
- Напишите математическое выражение для скорости реакции 2CO + O2 = 2CO2 и определите, во сколько раз увеличится скорость реакции при увеличении концентрации оксида углерода в четыре раза.
- Составьте молекулярные и ионно-молекулярные уравнения взаимодействия в растворах между: 1) CuSO4 + H2S → 2) BaCO3 + HNO3 → 3) FeC13 + KOH →
- Во сколько раз уменьшится скорость реакции при понижении температуры от 80 до 50 °С, если температурный коэффициент реакции равен 3 ?
- Составить химические формулы нижеследующих неорганичес-ких соединений.
- Какие из солей NaI, CrCl3, K2SiO3, (NH4)2SO3 подвергаются гидролизу?
- С какими из следующих веществ – NaOH, HCl, H2SO4, CO2, SO3, Na2O, CaO, Cu(NO3)2, H2O – будет реагировать неорганическое соединение: Оксид цинка.
