| 🎓 Заказ №: 22183 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
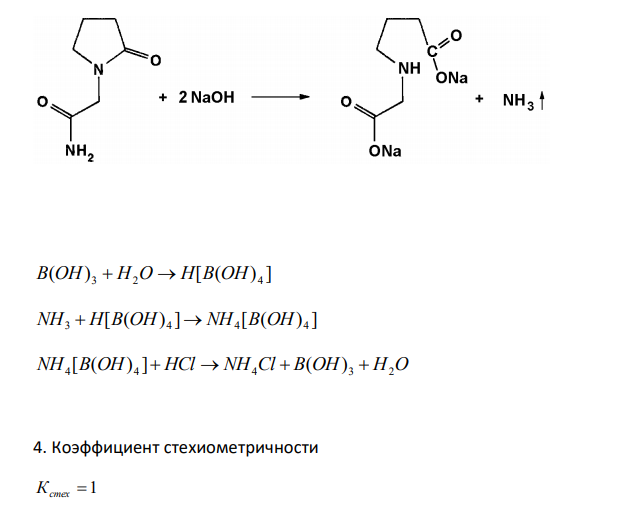
Дайте оценку качества субстанции пирацетама (М.м. 142,16) по количественному содержанию согласно требованиям ГФ XII, ФС 42-0269-07, с.79 (пирацетама должно быть не менее 98,0 % и не более 102,0 % в пересчете на сухое вещество), если титрование провели по нижеприведенной методике: 0,1512 г (точная навеска) тщательно растертой субстанции растворяют в 4 мл воды в колбе Кьельдаля. Колбу присоединяют к прибору для определения азота, из делительной воронки медленно прибавляют 45 мл 30 % раствора натрия гидроксида и отгоняют аммиак в приемник, в который предварительно помещают 15 мл раствора борной кислоты 4 % и 0,3 мл смешанного индикатора. Отгонку ведут до получения около 150 мл отгона. На титрование отгона израсходовалось 10,60 мл 0,1 М раствора хлористоводородной кислоты (Кп = 0,9994). На контрольный опыт израсходовалось 0,10 мл титранта. Потеря в массе при высушивании составляет 0,5 %.
Решение: 1. Количественное определение пирацетама выполняют методом Кьельдаля (видоизмененный вариант). 2. Метод основан на гидролитическом разложении пирацетама раствором натрия гидроксида по амидной группе, отгонке выделяющегося аммиака в приемник, поглощении аммиака раствором борной кислоты и последующем титровании отгона 0,1 М раствором хлористоводородной кислоты. Для индикации точки эквивалентности используется раствор смешанного индикатора. 3. Химизм ( ) [ ( ) ] B OH 3 H2O H B OH 4 [ ( ) ] [ ( ) ] NH3 H B OH 4 NH4 B OH 4 NH4 [B(OH) 4 ] HCl NH4Cl B(OH) 3 H2O 4. Коэффициент стехиометричности Кстех 1 5. Расчет титра раствора хлористоводородной кислоты по пирацетаму г мл мг мл М м К С HCl T стех 0,01422 / 14,22 / 1000 142,16 1 0,1 1000 . . ( ) 6. Формула расчета процентного содержания пирацетама (100 ) 1000 ( . . ) 100 100



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Сколько и какие значения может принимать магнитное квантовое число m при орбитальном квантовом числе: а) l = 0; б) l =1; в) l =2; г) l =3?
- Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cs2CO3, NiCl2, NH4CH3COO, LiNO2.
- Вычислите изменение энтропии при стандартных условиях для реакций: 2СН4(г) = С2Н2(г) + 3Н2(г) С (графит) + О2(г) = СО2(г)
- Определите, какой металл является анодом, а какой катодом в паре алюминий – железо.
- Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и HCl; б) Сr(ОН)3 и NaOH; в) 202 Ва(ОН)2 и СоСl2
- Определите, чему равен заряд следующих комплексных ионов:
- Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению , 92,59 . 5( ) 3( ) 2( ) PCl г PCl г Cl г H кДж
- Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты?
- Определить класс и назвать следующие неорганические соединения: SO3, Cu(OH)2, KHS, HNO2.
- Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2 б) Al(OН)3+ОН– = АlO– 2 +2Н2О в) Рb 2+ + 2I – = РbI2
