| 🎓 Заказ №: 22210 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
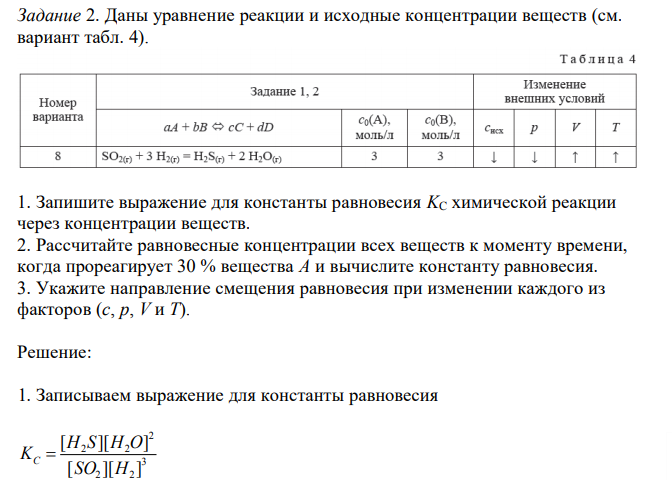
1. Запишите выражение для константы равновесия KC химической реакции через концентрации веществ. 2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия. 3. Укажите направление смещения равновесия при изменении каждого из факторов (с, p, V и T).
Решение: 1. Записываем выражение для константы равновесия 3 2 2 2 2 2 [ ][ ] [ ][ ] SO H H S H O KC 2. В соответствии с уравнением реакции к моменту времени, когда прореагирует 30 % SO2, концентрации веществ в системе будут иметь следующие значения SO SO моль л t 3 0,7 2,1 / 100 100 30 [ ] [ ] 2 2 0 H H SO SO моль л t t [ ] [ ] 3 ([ ] [ ] ) 3 3 (3 2,1) 0,3 / 2 2 0 2 0 2 H S SO SO моль л t t [ ] [ ] [ ] 3 2,1 0,9 / 2 2 0 2 H O SO SO моль л t t [ ] 2 ([ ] [ ] ) 2 (3 2,1) 1,8 / 2 2 0 2
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Запишите уравнения диссоциации и выражения для констант диссоциации (KД) по всем возможным ступеням, укажите их величины (см. приложение 2).
- Напишите выражение для константы равновесия реакции: Fе2О3 +3CO ↔ 2Fe + 3СО2
- Укажите численные значения главного и орбитального квантовых чисел данных подуровней, рассчитайте последовательность их заполнения б) Напишите электронные формулы предложенных атомов и ионов, укажите их положение в системе (номер периода, группа, подгруппа) 15 5d, 4p, 4d Cl; Pb2+
- Напишите термохимическое уравнение реакции образования 1 моля метана из оксида углерода (II) и водорода.
- Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи): Ba(CH3COO)2, CoSO4
- Подберите по три молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями: H OH H2O 3 2 3 2 Ba CO BaCO
- Напишите для CH3COOH и Fe(OH)3 уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их H2SO4 с и NaOH.
- До какого объёма следует разбавить 1,5 л 20%-ного раствора хлорида аммония (р=1,06 г/мл), чтобы получить 10%-ный раствор (р=1,03 г/мл).
- Какой объем 36 %-го раствора HCl (ρ = 1,18 г/мл) требуется для приготовления 1 л 2,5 н. раствора?
- Вычислите константу равновесия для гомогенной системы CО(г) + H2O(г) ↔ CO2(г) +H2(г), если равновесные концентрации реагирующих веществ [CO]=0,004 моль/л; [H2O]=0,064 моль/л; [CO2]=0,016 моль/л; [H2]=0,016 моль /л.
