| 🎓 Заказ №: 22196 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
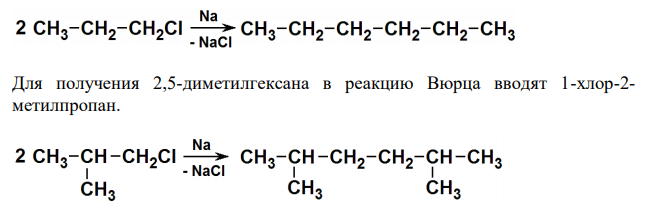
Из каких галогензамещенных углеводородов можно получить по реакции Вюрца: н-гексан и 2,5-диметилгексан? Какой из алканов можно получить с хорошим выходом по реакции Вюрца: 2,3-диметилгексан или 2,5- диметилгексан? Ответ обоснуйте.
Решение: Реакция Вюрца – взаимодействие галогеналканов с металлическим натрием, в результате чего получаются алканы с четным числом атомов углерода. Для получения н-алкана в реакцию Вюрца вводят 1-хлорпропан. Для получения 2,5-диметилгексана в реакцию Вюрца вводят 1-хлор-2- метилпропан.

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Две алюминиевые пластины склепаны одна с медью, другая со свинцом.
- Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4 . Начальная концентрация N2O = 6,0 моль/л..
- Определите изменение энергии Гиббса в реакции CuO + CO = Cu + CO2 при стандартных условиях, если HCuO = -126,9 кДж, HCO = -128 кДж, HCO2 = -236 кДж.
- Рассчитать время и расход электроэнергии при получении 1 м3 (н.у.) водорода током 3,5 А при напряжении 4,2 В и выходу по току 92 %.
- Сколько мл 56 %-ного раствора серной кислоты (ρ = 1,46 г/мл) нужно для приготовления 3 л 1М раствора?
- При взаимодействии 3,6 г металла с кислотой выделилось 1,25 л водорода.
- Сколько фосфорной кислоты необходимо взять по массе, если объем кислоты при н.у. составляет 25 л.
- Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей AgNO3, K2SO4.
- Исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n = 4; l = 1; ml= -1, 0; ms= +1/2, +1/2), напишите электронную формулу этого элемента, укажите его название и свойства – металл или неметалл.
- Приведите примеры препаратов, содержащих в своей структуре фенольный гидроксил, сложно-эфирную и амидные группы.
