| 🎓 Заказ №: 22223 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Какой металл: Zn, Mg или Ni может служить протектором для защиты от коррозии конструкции, изготовленной из Fe, Al и Со? Какая реакция протекает на поверхности Fe в процессе электрохимической коррозии в паре с протектором при рН = 8: А) 2Н+ + 2ē = Н2; Б) О2 + 2Н2О + 4ē = 4ОН– ; В) Fe – 2ē = Fe2+ ?
Решение: Стандартные электродные потенциалы перечисленных в условии металлов имеют следующие значения E B Zn Zn 0,763 / 2 E B Fe Fe 0,44 / 2 E B Mg Mg 2,37 / 2 E B Al Al 1,70 / 3 E B Ni Mg 0,25 / 2 E B Co Co 0,27

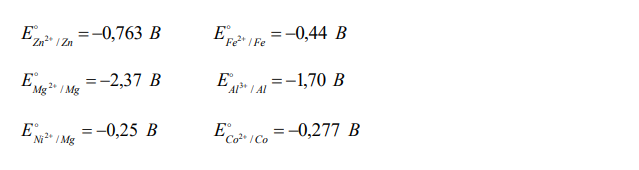
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Металл образует два хлорида, содержащие соответственно 73,86 и 84,96 % металла.
- Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5).
- Эквивалентная масса металла 8,99 г/экв.Какой объем водорода при 3ºС и 106,6 кПа
- Энергия активации реакции 2HI = Н2 + I2 равна 184 кДж/моль, а константа скорости реакции при 556 К равна 3,5∙107 л/моль∙сек.
- При пропускании тока через последовательно соединенные электролизеры с растворами солей CuCl2 и KNO3 на аноде второго выделилось 11,2 дм3 газа (нормальные условия).
- Рассчитать рН растворов следующих веществ, определить концентрации ионов [H + ] и [OH- ] (моль/л) в растворе: HF
- Определите расход электроэнергии на восстановление изношенных распределительных и коленчатых валов электрохромированием, если процесс проводится при напряжении 6,5 В, суммарная поверхность изделий составляет 0,50 м2 , толщина слоя хрома достигает 100 мкм, а выход по току равен 0,30
- По формулам написать названия веществ: а) Cu2O, б) HCl, в) (CH3COO)2Ca, г) Ti(OH)2SO4; по названию написать формулы веществ: а) сульфат лития, б) гидроксид меди (II), дигидрофосфат натрия.
- Написать уравнения диссоциации следующих соединений: CrOH(NO3)2, CsOH, H2SiO3, ZnBr2.
- При взаимодействии 2,960 г карбоната металла с хлороводородной кислотой получено 3,124 г хлорида металла.
