| 🎓 Заказ №: 22177 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
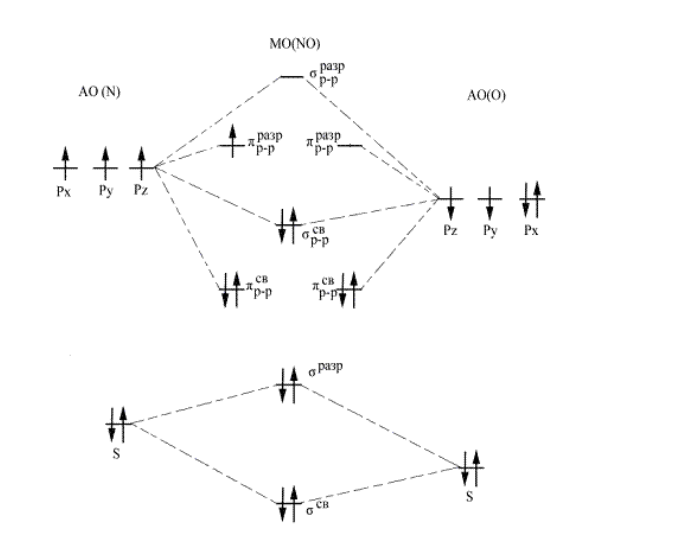
Назовите двухатомные молекулы элементов 1-го и 2-го периодов, у которых: 1) отрыв электрона приводит к усилению связи, 2) прибавление электрона приводит к ослаблению связи. Объясните причины этих явлений. Постройте энергетические диаграммы молекулярных орбиталей ионов и молекул.
Решение: В методе молекулярных орбиталей молекула рассматривается как единая система, содержащая ядра и электроны. Если комбинируются две атомные орбитали, то образуются две молекулярные орбитали, отличные по энергии от исходных атомных. Одна из них соответствует более низкой энергии электронов (связывающая молекулярная орбиталь), а вторая – более высокой энергии электронов (разрыхляющая молекулярная орбиталь) по сравнению с их энергией на атомных орбиталях Порядок размещения электронов по молекулярным орбиталям: прежде всего заполняются орбитали с низкой энергией, заполнение орбиталей подчиняется принципу Паули и правилу Хунда. 1) Электронное строение молекулы NO [ ( ) ( ) ( ) ( ) ( ) ( ) ] 1 2 2 2 2 2 2 2 2 2 2 2 разр p св p св p св p разр s св KK s Энергетическая диаграмма МО молекулы NO имеет следующий вид Под кратностью (порядком) связи в методе молекулярных орбиталей понимают полуразность числа связывающих и числа разрыхляющих электронов. Чем выше кратность связи, тем больше энергия разрыва связи, тем прочнее связь. На связывающих орбиталях находится 8 электронов, на разрыхляющих 3 электрона. Кратность связи равна 2,5 2 8 3 . . к с Электронное строение частицы NO+ [ ( ) ( ) ( ) ( ) ( ) ] 2 2 2 2 2 2 2 2 2 2 св p св p св p разр s св KK s Энергетическая диаграмма МО частицы NO+ имеет следующий вид



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Напишите формулу ЛС, исходя из химического названия: (-)-3-(3,4-диоксифенил)-L-аланин.
- Фотометрия, как общий метод количественного определения ЛС, производных 5-нитрофурана.
- Дайте обоснование методу количественного определения фурадонина (ФС 42-3217-95). Методика: около 0,4 г препарата (точная навеска), высушенного до постоянной массы, растворяют в 20 мл диметилформамида и титруют 0,1 М раствором натрия метилата до темно-зеленого окрашивания (индика- тор – 0,15 мл раствора тимолового синего).
- Напишите уравнения реакций между: а) селеновой кислотой и гидроксидом стронция; б) хлорной кислотой и карбонатом лития; в) гидроксидом галлия и хромовой кислотой.
- Во сколько раз увеличится скорость протекающей в газовой фазе реакции 4H2(г) + 2NO2(г) = 4H2O(г) + N2(г), если температуру повысить от 30° до 60°?
- Плотность 18 М раствора H2SO4 1,84 г/мл. Вычислите, чему равны молярная и массовая доля (%) H2SO4 в данном растворе.
- Вычислите энтальпию реакции разложения карбоната кальция на оксиды; определите, сколько тепла потребуется для получения 100 м3 (объем измерен при н.у.) углекислого газа по этой реакции.
- Рассчитайте защитную плотность тока, если цинковый протектор весом 10 кг действует в течение двух лет, а его зона действия 13 м2
- Приведите энергетическую схему строения гомоядерной молекулы F2 в методе МО.
- Вычислите изменение внутренней энергии при испарении 50 г воды, если на испарение 1 моль воды расходуется 40,7 кДж тепла, а изменение объема системы при испарении 1 г воды равно 1,7 дм3 .
