| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
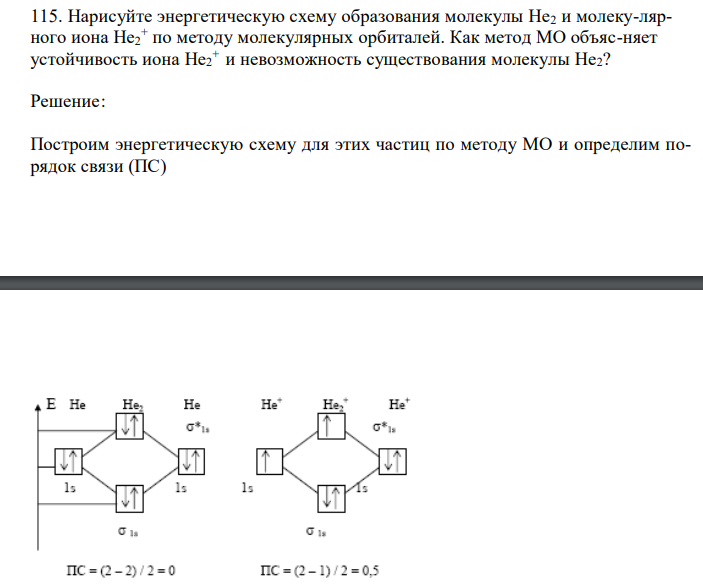
Нарисуйте энергетическую схему образования молекулы Не2 и молеку-лярного иона Не2 + по методу молекулярных орбиталей. Как метод МО объяс-няет устойчивость иона Не2 + и невозможность существования молекулы Не2?
Решение: Построим энергетическую схему для этих частиц по методу МО и определим порядок связи (ПС)
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Рассчитайте э.д.с. гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1 М растворы их азотнокислых солей.
- Составьте молекулярные и ионные уравнения гидролиза солей Na2S, NH4NO3, FeSO4.
- Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы.
- Подсчитав тепловой эффект и изменение энергии Гиббса при 25ºC для реакции CO г H г CH г H Oж 2 4 2 4 2 2 , определите S для этой реакции.
- Давление пара воды при 80ºС равно 47,3 кПа.
- Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния?
- Сущность процесса гидролиза хлорида цинка.
- Какова нормальность 20 %-го раствора соляной кислоты с плотностью 1,102 г/мл?
- Выявить, какое вещество является окислителем, а какое – восстановителем, составить уравнения электронного баланса и расставить коэффициенты в приведенных ниже уравнениях окислительно-восстановительных реакций. а) KI + KIO3 + H2SO4 → I2 + K2SO4 + H2O; б) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O.
- Вычислить температурный коэффициент, зная, что при повышении температуры на 60º скорость реакции возрастает в 729 раз.
