| 🎓 Заказ №: 22179 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: Bi HNO3( разб) Bi(NO3 ) 3 NO H2O H SO Cl H O H SO HCl 2 3 2 2 2 4 Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое восстанавливается ?
Решение: Bi H N O разб Bi NO N O H2O 2 3 3 3 3( ) 0 5 ( ) В ходе данной окислительно-восстановительной реакции степень окисления висмута повышается от 0 до +3, степень окисления части азота понижается от +5 до +2. 0 3 3 Bi e Bi 1 окисление Bi — восстановитель 5 2 3 N e N 1 восстановление HNO3 – окислитель Bi HNO3( разб) Bi(NO3 ) 3 NO H2O Одна молекула азотной кислоты расходуется на образование одной молекулы оксида азота (II), ещё три молекулы азотной кислоты необходимы для образования нитрата висмута. Для уравнивания ставим перед формулой HNO3 коэффициент 4. Bi 4H

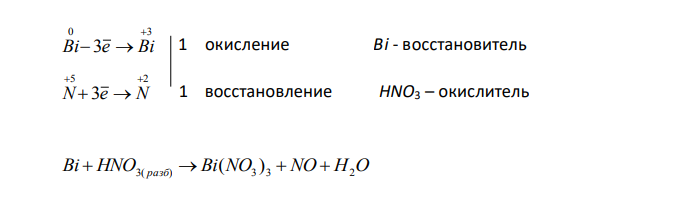
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Исходя из степени окисления серы в сульфиде железа и азота в азотной кислоте, определите, какое вещество является окислителем, какое восстановителем, составьте ионно-электронные уравнения и расставьте коэффициенты в следующей реакции:
- В атомах каких элементов IV периода наибольшее число непарных dэлектронов?
- Напишите электронную конфигурацию атомов, пользуясь электронными формулами для элементов с порядковыми номерами 12, 25, 31, 34, 45
- Напишите строение мицеллы золя, образованного в результате взаимодействия указанных веществ (избытка одного, затем другого вещества) CdSO4 + H2S →
- Составьте схему гальванического элемента, при работе которого протекает реакция Ni + Pb(NO3) = Ni(NO3)2 + Pb.
- В 150 мл воды растворили 11 г 98 % серной кислоты. Определите массовую долю серной кислоты в полученном растворе, а также молярную и нормальную концентрации.
- Определите по правилу Клечковского порядок заполнения электронами подуровней в атомах элементов, если их суммы n+1 соответственно равны 4, 5 и 6 ?
- При сжигании в недостатке кислорода 11 л сероводорода с последующим охлаждением выделилась сера.
- На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: KMnO4 K2 SO3 H2 SO4 MnSO4 K2 SO4 H2O Сl2 KOH (гор.) КСl KClO3 H2O
- Расставьте коэффициенты методом электронного баланса в реакциях: Ca + CO2 = CaO + C CO2 + C = CO
