| 🎓 Заказ №: 22215 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Обоснуйте испытание аскорбиновой кислоты по показателю «Кислота щавелевая» в соответствии с методикой и требованиями ФС.2.1.0058.18 (Приложение № 3). Укажите категорию примеси, ее допустимость, способ испытания. Приведите химизм реакций.
Решение Кислота щавелевая является специфической допустимой (не более 0,2 %) примесью в аскорбиновой кислоте. Определение содержания кислоты щавелевой основано на её способности образовывать с раствором кальция хлорида в слабокислой среде малорасторимое соединение (оксалат кальция) в виде опалесценции или осадка. Химизм

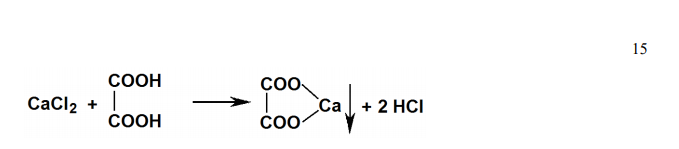
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Рассчитайте и укажите степень окисления (CO) атомов элементов в предложенных частицах: 2- SO4 , CO, H2S, 2- MnO4 .
- Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС цинко-магниевого гальванического элемента, в котором активность ионов цинка a моль л Zn 1 10 / 1 2 , а ионов магния a 2 1,0 моль / л.
- Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи): CuSO4, K3PO4.
- Напишите в молекулярной и ионной формах уравнения возможных реакций предложенных оксидов (CdO; SnO) с H2O, Na2O, KOH, HNO3.
- Водный раствор содержит массу m вещества А в объеме V. Плотность раствора ρ. ρ = 1,44 г/мл
- Вычислите стандартные изменения (при 298 К) энтальпии, энтропии и свободной энергии Гиббса реакции. По данным Fe3O4(тв) + 4H2(г) = 3Fe(тв) + 4H2O(г)
- Описать и объяснить возможность использования инструментальных методов анализа (оптических, электрохимических, хроматографических) для качественного и количественного определения: а) иодид натрия
- Составьте схему и напишите уравнения электродных процессов, протекающих на кобальтовых электродах (с учетом перенапряжения) при электролизе водного раствора соли NiSO4 в стандартных условиях, при активности Ni2+= 1 моль/л (среда кислая, рН < 7), температуре 298 К, плотности тока i = 10 А/м2 , 2 2,01 . 4 2 2 8 / 2 В
- Вычислите H реакции перехода графита в алмаз, исходя из термохимических уравнений следующих реакций
- Вода объемом 1 л содержит 38,0 мг гидрокарбоната кальция и 19,6 мг сульфата магния.
