| 🎓 Заказ №: 22223 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
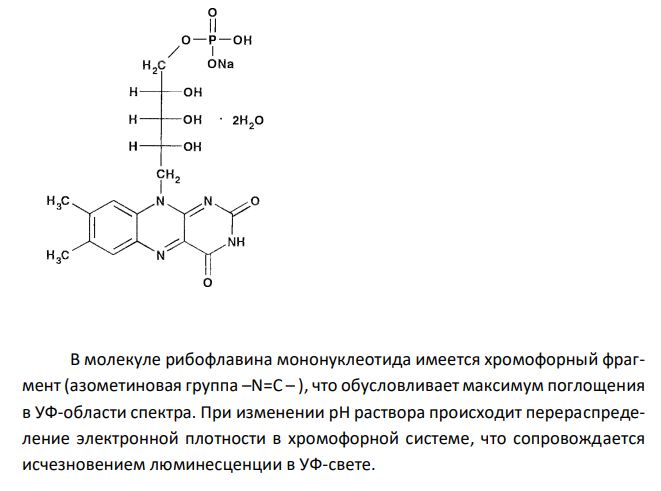
Обоснуйте и приведите химизм реакций определения подлинности рибофлавина- мононуклеотида по методикам НД: — 0,2 г ЛС растворяют в 20 мл воды, 10 мл этого раствора просматривают в УФ свете, наблюдается зеленая флуоресценция, исчезающая при прибавлении щелочи или кислоты; — 0,05 г ЛС в 3 мл концентрированной азотной кислоты, кипятят в течение 5 минут, прибавляют 10 мл воды. К 1 мл полученного раствора прибавляют 1 мл раствора аммония хлорида, 1 мл раствора аммиака и 0,5 мл раствора магния сульфата; образуется белый кристаллический осадок.
Решение: Рибофлавина мононуклеотид. В молекуле рибофлавина мононуклеотида имеется хромофорный фрагмент (азометиновая группа –N=C – ), что обусловливает максимум поглощения в УФ-области спектра. При изменении рН раствора происходит перераспределение электронной плотности в хромофорной системе, что сопровождается исчезновением люминесценции в УФ-свете.

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III).
- Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными: Cu+2 + S-2 = CuS↓ Ca+2 + SiO3 -2 = CaSiO3↓
- Соотнесите ЛС и метод его количественного определения с молярной массой эквивалента (приведите химизм и обоснование метода, выведите молярную массу эквивалента) Пиридоксина гидрохлорид.
- Какой физический смысл имеет порядковый номер и почему химические свойства, в конечном счете, определяются зарядом ядра атома?
- Соответствует ли натрия хлорид требованиям ГФ, если на 5 мл раствора, полученного после растворения 1,0142 г натрия хлорида в мерной колбе на 50 мл, израсходовано 17,3 мл раствора серебра нитрата с концентрацией 0,1 моль/л?
- Определите элемент по следующему описанию: а) щелочной металл, у которого валентным является 4s 1 -электрон; б) благородный газ, содержащий на внешнем энергетическом уровне меньше восьма электронов; в) элемент с одним неспаренным 2p-электроном; г) самый легкий элемент, внешний энергетический уровень которого содержит pхpypz-электроны.
- Обоснуйте и приведите химизм реакций определения подлинности тиамина хлорида 5 % для инъекций (ФС 42-1414-94).
- Как влияет на равновесие в гетерогенной системе FeO(т) H2(г) Fe(т) H2O(г) , H 23 кДж а) изменение давления; б) увеличение концентрации H2; в) удаление Fe; г) повышение температуры; д) снижение температуры?
- Давление водяного пара при температуре 65 °С равно 25003 Па.
- Составьте электронные уравнения и укажите, какой процесс (окисление или восстановление) происходит при следующих превращениях Se0→Se6+ , Cl0→Cl5+ , N 5+→N 3- .
