| 🎓 Заказ №: 22183 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Объясните, что такое обратимые и необратимые, экзергонические и эндергонические реакции. Приведите примеры этих реакций из цикла Кребса или гликолиза.
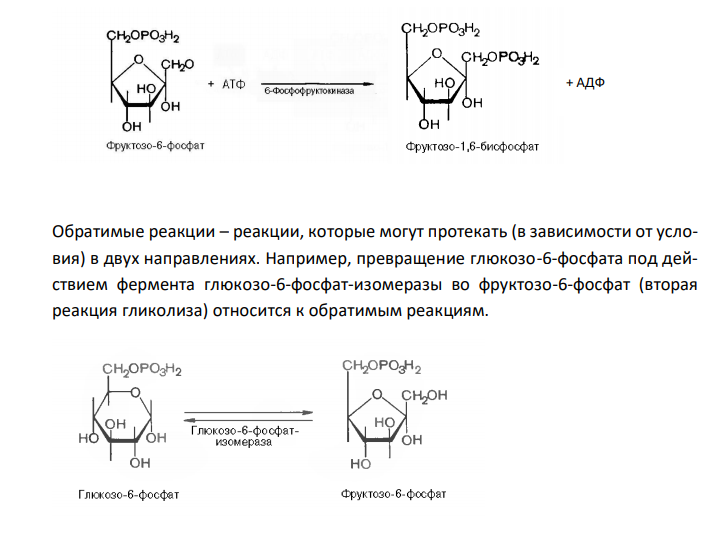
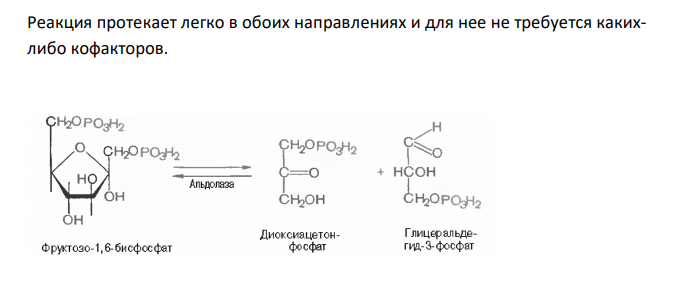
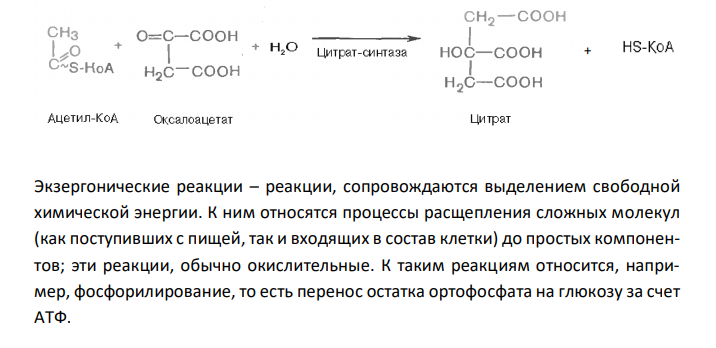
Решение: Необратимые реакции – реакции, при которых исходные вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях. К таким реакциям относятся, например, реакции горения углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Например, фосфорилирование фруктозо-6-фосфата под действием 6-фосфофруктокиназы (третья реакция гликолиза) является необратимым. Обратимые реакции – реакции, которые могут протекать (в зависимости от условия) в двух направлениях. Например, превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат (вторая реакция гликолиза) относится к обратимым реакциям. Реакция протекает легко в обоих направлениях и для нее не требуется какихлибо кофакторов. + АДФ Эта реакция также обратима. При повышении температуры равновесие сдвигается в сторону бóльшего образования диоксиацетонфосфата и глицеральдегид3-фосфата. Эндергонические реакции – реакции, сопровождающиеяся поглощением энергии; для их протекания необходима энергия из внешнего источника. К эндергоническим относятся реакции, направленные на образование и обновление структурных элементов клеток и тканей, то есть реакции синтеза слож-ных молекул из более простых. Например, такой реакцией является фосфорилирование АДФ с образованием АТФ. АДФ + Н3РО4 → АТФ Образование лимонной кислоты, с синтеза которой начинается цикл Кребса, при помощи цитрат-синтазы, также протекает с поглощением энергии. Реализация этой реакции возможна благодаря использованию богатой энергией связи ацетильного остатка с KoA. Экзергонические реакции – реакции, сопровождаются выделением свободной химической энергии. К ним относятся процессы расщепления сложных молекул (как поступивших с пищей, так и входящих в состав клетки) до простых компонентов; эти реакции, обычно окислительные. К таким реакциям относится, например, фосфорилирование, то есть перенос остатка ортофосфата на глюкозу за счет АТФ.


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Какую навеску тиреоидина необходимо взять для количественного определения, чтобы на титрование израсходовалось 5 мл 0,01 М раствора натрия тиосульфата.
- Определите порядок реакции и рассчитайте, как изменится начальная скорость гомогенных химических реакций согласно закону действующих масс: 2H2O2 2H2O + O2; v = k [H2O2];если разбавить раствор в 4 раза
- Рассчитать изменение скорости реакции при изменении температуры: при повышении Т от 20ºС до 50ºС, если k10= 6 c -1 и k20= 18 c -1
- Определите массу (г) сульфита натрия Na2SO3, необходимую для приготовления 0,4 л 0,6 н. раствора, предназначенного для изучения восстановительных свойств этого вещества в щелочной среде: SO OH e SO H2O
- Вычислите молярную концентрацию эквивалентов соляной кислоты в 80 мл раствора, содержащего 3,6 г HCl, вступившей в реакцию по уравнению 2HCl Ca(OH) 2 CaCl2 2H2O
- Определите, как влияет повышение температуры на смещение равновесия и при какой температуре направление реакции сменится на противоположное (зависимостью H и S реакций температуры пренебречь): 2NaHCO3(тв.) Na2CO3(тв.) + H2O(г.) + CO2(г.)
- Из 800 г 2 %-ного раствора соляной кислоты HCl выпарили 300 г воды.
- Температурный коэффициент скорости реакции равен 3,5.
- Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой?
- Напишите структурными формулами химические реакции расщепления крахмала в пищеварительном тракте, охарактеризуйте ферменты, участвующие в этом процессе и механизм всасывания глюкозы.
