| 🎓 Заказ №: 22206 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Охарактеризуйте ароматичность изохинолина. Приведите способ его получения, химические свойства. Напишите структурные формулы производных изохинолина, используемых в качестве фармпрепаратов. Приведите схему синтеза барбитуровой кислоты. Охарактеризуйте ее кислотные свойства, лактим-лактамную и кето-енольную таутомерии. Напишите структурные формулы следующих производных барбитуровой кислоты: барбитала (веронала), фенобарбитала (люминала), натриевой соли барбитала (мединала). Опишите их применение в медицинской практике, дайте химические названия.
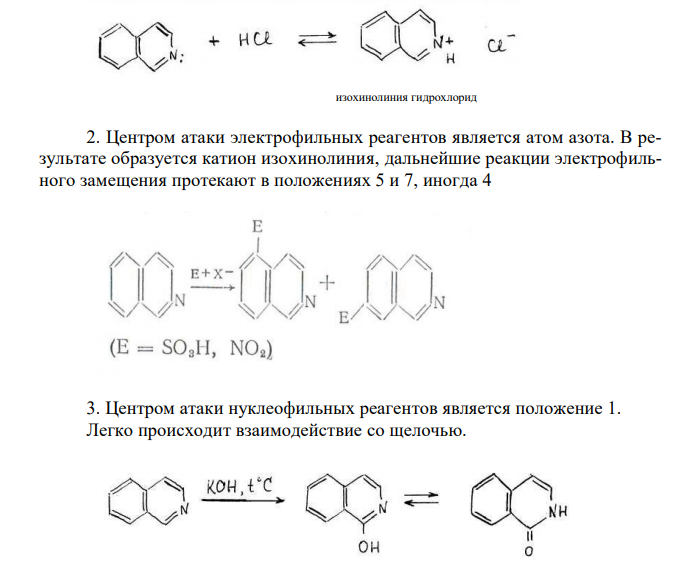
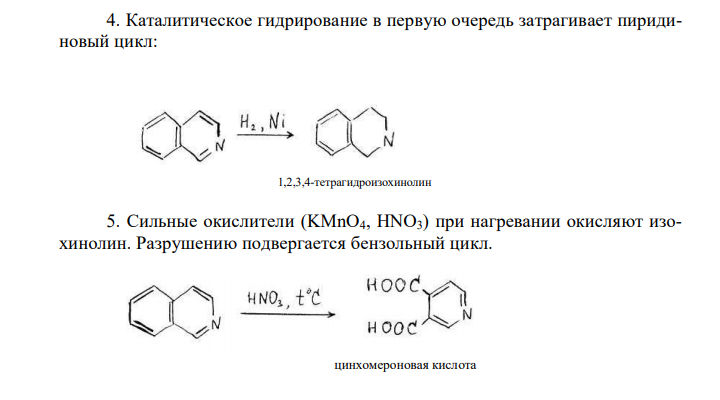
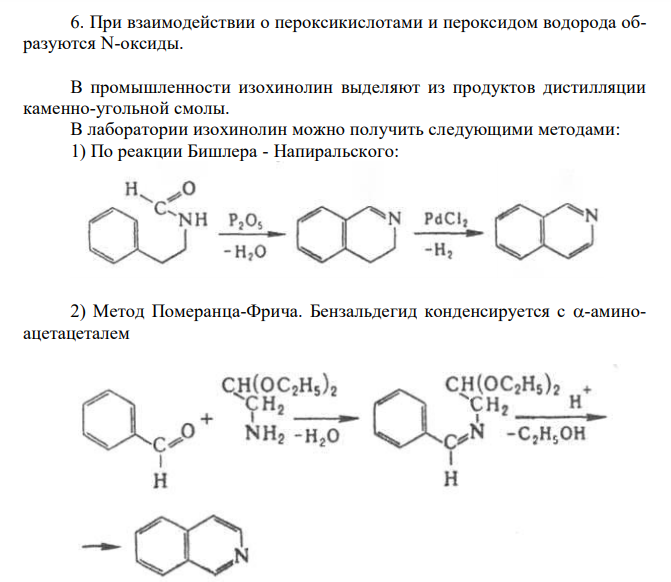
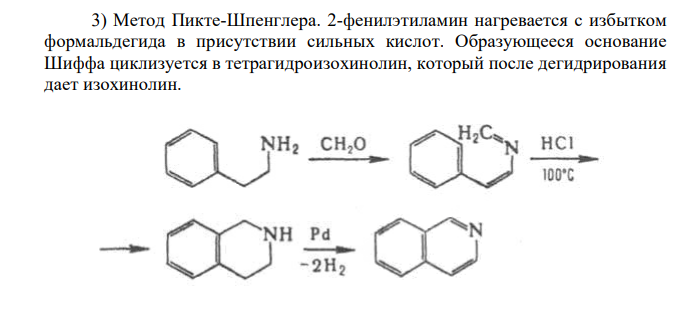
Решение: Изохинолин (бензо [с] пиридин) Изохинолин – азааналог нафталина, содержит сопряженную π-электронную систему из 10 π-электронов, включая неподеленную пару электронов атома азота, что соотвествует формуле Хюккеля (4n + 2 при n = 2). Присутствие атома азота значительно изменяет распределение π-электронной плотности. Химические свойства изохинолина 1. Изохинолин является слабым основанием, образует соли с сильными кислотами: 2. Центром атаки электрофильных реагентов является атом азота. В результате образуется катион изохинолиния, дальнейшие реакции электрофильного замещения протекают в положениях 5 и 7, иногда 4 3. Центром атаки нуклеофильных реагентов является положение 1. Легко происходит взаимодействие со щелочью. 4. Каталитическое гидрирование в первую очередь затрагивает пиридиновый цикл: 1,2,3,4-тетрагидроизохинолин 5. Сильные окислители (KMnO4, HNO3) при нагревании окисляют изохинолин. Разрушению подвергается бензольный цикл. цинхомероновая кислота 6. При взаимодействии о пероксикислотами и пероксидом водорода образуются N-оксиды. В промышленности изохинолин выделяют из продуктов дистилляции каменно-угольной смолы. В лаборатории изохинолин можно получить следующими методами: 1) По реакции Бишлера — Напиральского: 2) Метод Померанца-Фрича. Бензальдегид конденсируется с -аминоацетацеталем 3) Метод Пикте-Шпенглера. 2-фенилэтиламин нагревается с избытком формальдегида в присутствии сильных кислот. Образующееся основание Шиффа циклизуется в тетрагидроизохинолин, который после дегидрирования дает изохинолин.

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Определите энергию перехода электрона в атоме водорода, которой соответствует красная линия спектра испускания (l = 656 нм).
- Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций и укажите направление смещения равновесия при изменении условий.
- Массовая доля железа в хлориде составляет 0,3446.
- Восстановление оксида железа (III) водородом до свободного металла по уравнению Fe2O3(к)+ 3Н2(г) = 2Fe(к) + 3Н2О(г) сопровождается поглощением 96,2 кДж теплоты.
- Найти окислитель, восстановитель и составить окислительно-восстановительное уравнение процесса, используя метод электронно-ионного баланса
- Сколько литров водорода (н.у.) потребуется для восстановления 112 г оксида металла, содержащего 71,43 % мас. металла?
- Рассчитайте стандартную ЭДС элемента, в котором установилось равновесие: Mg + Zn2+ ↔ Mg2+ + Zn; 10 / , 10 / .
- Как необходимо изменить температуру, давление и концентрацию, чтобы сместить равновесие вправо?
- Какие химические частицы находятся в узлах кристаллической решетки соединений с ионной связью ?
- Обоснуйте испытание метенамина по показателю «Свободный формальдегид» в соответствии с методикой и требованиями ФС.2.1.0131.18 (Приложение № 3).
