| 🎓 Заказ №: 22175 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Парацетамол (ГФ XII, ФС 42-0268-07), с.83 1. Растворимость в спирте. 2. Реакции на подлинность с железа (III) хлоридом. 3. Испытание на чистоту: сульфаты, тяжелые металлы в сульфатной золе. 4. Количественное определение, применение.
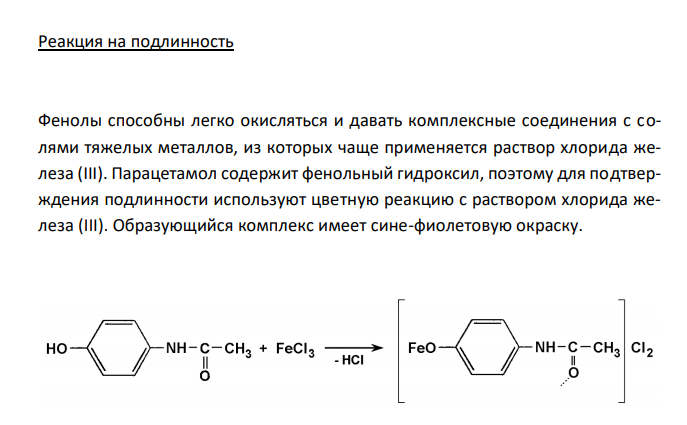
Решение: Парацетамол, Paracetamol Растворимость в спирте Растворимость веществ в ГФ XI выражается либо в частях, либо в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г препарата. ГФ XI допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически не растворим». Согласно ФС 42-0268-07, парацетамол легко растворим в спирте 96 %. То есть, для растворения 1 г препарата необходим объем спирта 96 % от 1 до 10 мл. Для подтверждения подлинности и доброкачественности навеску предварительно растертого парацетамола массой 1,00 г вносят в 1 мл спирта 96 % и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В случае неполного растворения препарата постепенно небольшими порциями прибавляют спирт 96 % (до объема 10 мл) при непрерывном встряхивании. Если навеска полностью растворится в объеме спирта 96 % от 1 до 10 мл, то делают вывод о доброкачественности препарата. Реакция на подлинность Фенолы способны легко окисляться и давать комплексные соединения с солями тяжелых металлов, из которых чаще применяется раствор хлорида железа (III). Парацетамол содержит фенольный гидроксил, поэтому для подтверждения подлинности используют цветную реакцию с раствором хлорида железа (III). Образующийся комплекс имеет сине-фиолетовую окраску.



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Напишите химическую формулу ЛС, исходя из рационального названия: [2- (Диэтиламино)-этил]-4-аминобензойной кислоты гидрохлорид.
- Напишите уравнения реакций образования следующих соединений: CaS, FeCl2, Al2O3, CsF.
- Рассматриваются молекула N2 и молекулярные ионы N2 + и N2 — .
- Исходя из обменного механизма образования ковалентной связи, объяснить, какой из двух атомов может проявлять валентность, равную номеру группы.
- Напишите молекулярные и ионно-молекулярные уравнения гидролиза следующих солей и укажите реакцию среды раствора: Mn (NO3)2; Na3PO3; (NH4)2CO3.
- Валентные электроны атома химического элемента характеризуются следующим набором квантовых чисел n, l, ml и mS соответственно: 3, 2, 2, +1/2; 4, 0, 0, +1/2; 4, 0, 0, -1/2. О каком элементе идет речь?
- Написать структурные формулы следующих соединений: гидроксид магния, силикат натрия, ортофосфорная кислота, нитрит калия, оксид бериллия.
- Константа равновесия гомогенной реакции N2 + 3H2 ↔ 2 NH3 при некоторой температуре равна 1.
- Что означает понятие сильная кислота?
- Вычислите эквивалент и эквивалентную массу бора, хрома и кальция в соединениях: B2O3; Cr(OH)3; Ca3(PO4)2.
