| 🎓 Заказ №: 22183 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
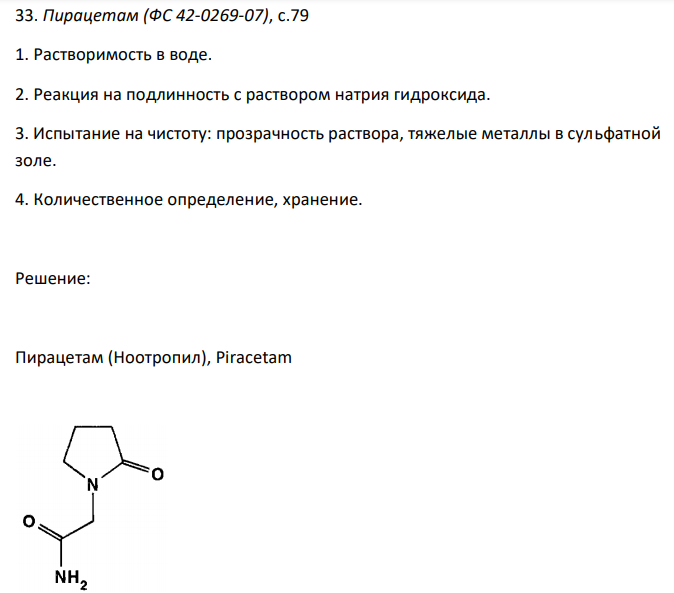
Пирацетам (ФС 42-0269-07), с.79 1. Растворимость в воде. 2. Реакция на подлинность с раствором натрия гидроксида. 3. Испытание на чистоту: прозрачность раствора, тяжелые металлы в сульфатной золе. 4. Количественное определение, хранение.
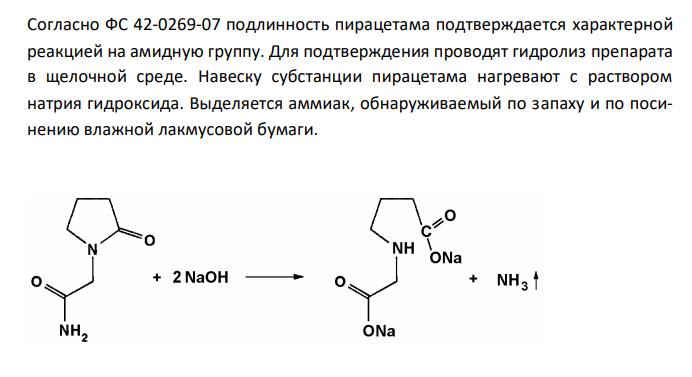
Решение: Пирацетам (Ноотропил), Piracetam Растворимость в воде Растворимость ЛС, согласно ОФС 42-0049-07, выражается в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г субстанции. ОФС 42-0049-07 допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически нерастворим». Согласно ФС 42-0269-07, пирацетам легко растворим в воде. То есть, для растворения 1 г препарата необходим объем воды от 1 до 10 мл. К субстанции пирацетама массой 1,00 мг, растертой в тонкий порошок, прибавляют 10 мл воды и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Субстанцию считают растворившейся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. Реакция на подлинность с раствором натрия гидроксида Согласно ФС 42-0269-07 подлинность пирацетама подтверждается характерной реакцией на амидную группу. Для подтверждения проводят гидролиз препарата в щелочной среде. Навеску субстанции пирацетама нагревают с раствором натрия гидроксида. Выделяется аммиак, обнаруживаемый по запаху и по посинению влажной лакмусовой бумаги. Испытание на прозрачность раствора Один из методов оценки чистоты пирацетама – определение прозрачности его водного раствора. Согласно ОФС 42-0051-07 прозрачность жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталонами визуально или инструментальным методом. Эталонами для определения прозрачности, служат взвеси из гидразина сульфата и гексаметилентетрамина. Вначале готовят растворы гидразина сульфата и гексаметилентатрамина. Потом смешением равных объемов приготовленных растворов получают исходный эталон. После выдерживания исходного эталона в течение 24 час из него приготавливают основной эталон. Путем смешивания определенных объемов основного эталона с водой приготавливают эталоны сравнения. Согласно 42-0269-07, вывод о чистоте пирацетама делают, если раствор 1 г субстанции в 10 мл воды является прозрачным или выдерживает сравнение с эталоном I (не превышает по мутности). Испытание тяжелые металлы в сульфатной золе Пирацетам относится к органическим веществам и сгорает полностью, не оставляя остатка. Для оценки чистоты пирацетама, в числе прочих методов, используют испытание на массовую долю тяжелых металлов в сульфатной золе. Данное испытание проводится, чтобы подтвердить или опровергнуть наличие в ЛС несгораемых неорганических примесей, прежде всего соединений тяжелых металлов. Согласно ОФС 42-0056-07, для образования сульфатной золы точную навеску субстанции массой около 1 г помещают в тигель, смачивают серной кислотой концентрированной и прокаливают при 600 °С до постоянной массы. Определение содержания примесей тяжелых металлов в ЛС основано на образовании окрашенных сульфидов. Согласно ОФС 42-0059-07, в качестве источника сульфидов



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте электронные схемы строения молекул Cl2, H2S, CCl4.
- Какие из веществ: Pb(OH)2; Ba(OH)2; H2SO4 будут взаимодействовать с гидроксидом натрия ?
- Как получают в промышленности стирол ?
- Напишите уравнения электролитической диссоциации: а) азотной кислоты; б) гидросульфида натрия; в) гидроксида бериллия.
- В 60 г H2O растворили 20 мл 40 %-го раствора H3PO4 (d = 1,254 г/см3 ).
- Объясните, почему вода при комнатной температуре – жидкость, а ее более тяжелые аналоги – H2S, H2Se и H2Te – газы?
- Вычислить рН буферных растворов, полученных при сливании растворов: а) 60 см3 0,01 М CH3COOH и 40 см3 0,05 М CH3COOK. б) 70 см3 0,01 М NH4Cl и 30 см3 0,05 М NH4OH.
- Напишите уравнение реакции взаимодействия, подберите коэффициенты методом электронно-ионного баланса в окислительно-восстановительной реакции между иодидом калия и пероксидом водорода, если при этом образуются молекулярный йод и едкое кали.
- К растворам NH4OH, K2S, Pb(NO3)2, NaNO3 (к каждому в отдельности) прибавили соляной кислоты.
- Как изменяются свойства элементов с увеличением порядкового номера в периодах и главных подгруппах периодической системы ?
