| 🎓 Заказ №: 22176 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Предложите схему анализа смеси катионов четвертой аналитической группы по кислотно-основной классификации. Напишите уравнения реакций, укажите условия их проведения и аналитический эффект. Как доказать наличие арсенат-иона в присутствии фосфат-иона ?
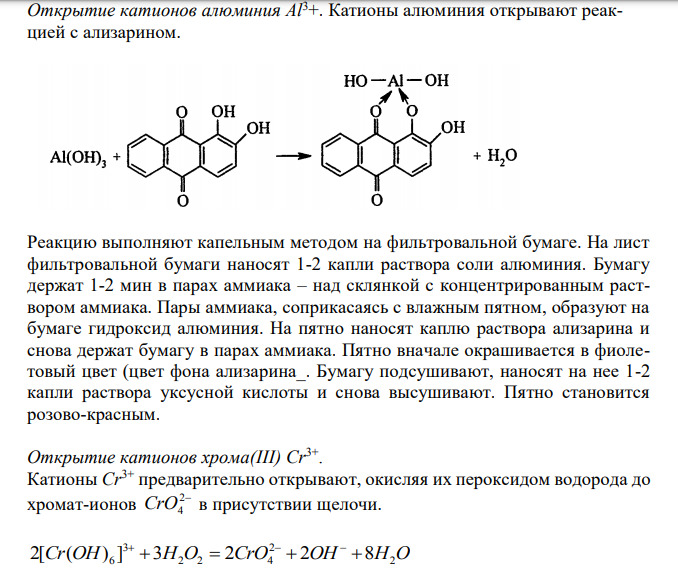
Решение: В четвертую группу катионов по кислотно-основной классификации объединены катионы: 2 3 2 4 3 5 3 Zn , Al ,Sn ,Sn , As , As ,Cr Анализ раствора, содержащего смесь всех катионов четвертой аналитической группы, ведут по следующей схеме. Вначале проводят предварительные испытания: в отдельных небольших пробах (несколько капель) анализируемого раствора дробным методом открывают катионы, присутствующие в растворе, учитывая мешающее действие отдельных катионов друг на друга. Далее проводят систематический анализ. 232 232 Открытие катионов алюминия Al3+. Катионы алюминия открывают реакцией с ализарином. Реакцию выполняют капельным методом на фильтровальной бумаге. На лист фильтровальной бумаги наносят 1-2 капли раствора соли алюминия. Бумагу держат 1-2 мин в парах аммиака – над склянкой с концентрированным раствором аммиака. Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия. На пятно наносят каплю раствора ализарина и снова держат бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет (цвет фона ализарина_. Бумагу подсушивают, наносят на нее 1-2 капли раствора уксусной кислоты и снова высушивают. Пятно становится розово-красным. Открытие катионов хрома(III) Cr3+ . Катионы Cr3+ предварительно открывают, окисляя их пероксидом водорода до хромат-ионов 2 CrO4 в присутствии щелочи. Cr OH H O CrO OH H2O 2 2 2 4 3 2[ ( ) 6 ] 3 2 2 8 Если при прибавлении к пробе анализируемого раствора нескольких капель пероксида водорода и щелочи раствор окрашивается в желтый цвет, то это указывает на присутствие катионов Сr 3+, которые окислились до хромат-ионов, придающих раствору желтую окраску. Открытие олова(II). Присутствие олова(II) доказывают реакциями с солью висмута(III) в щелочной среде и с солью ртути(II).

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Рассчитайте объем газа HCl (л, н.у.), который полностью поглощается 1 л воды с образованием раствора с массовой долей ω(%) – 1.
- Установите термодинамическую вероятность протекания электрохимической коррозии при повреждении катодного покрытия на стальном изделии в растворе серной кислоты.
- Вычислите концентрацию ионов OH- и рОН для раствора, рН которого равен 8,4.
- В гомогенной реакции SO2+O2→SO3 начальные концентрации диоксида серы и кислорода равны 0,04 моль/л и 0,03 моль/л, соответственно.
- Вычислите исходные концентрации азота и водорода и константу равновесия, если равновесные концентрации веществ в обратимой реакции N2 + 3H2 ↔ 2NH3 составляют: [N2]p, 2 моль/л; [H2]p, 3 моль/л; [NH3]p, 4 моль/л.
- В 1 кг воды растворено 666 г KOH; плотность раствора 1,395 г/мл.
- Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ.
- На нейтрализацию 2,3 г основания израсходовано 2,14 г НСl.
- Используя термодинамические данные рассчитать константу равновесия системы N2+H2↔NH3 при 450°С (зависимостью ΔH и ΔS от температуры пренебречь).
- Расставьте коэффициенты уравнениях реакций замещения методом электронного баланса.
