| 🎓 Заказ №: 22215 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
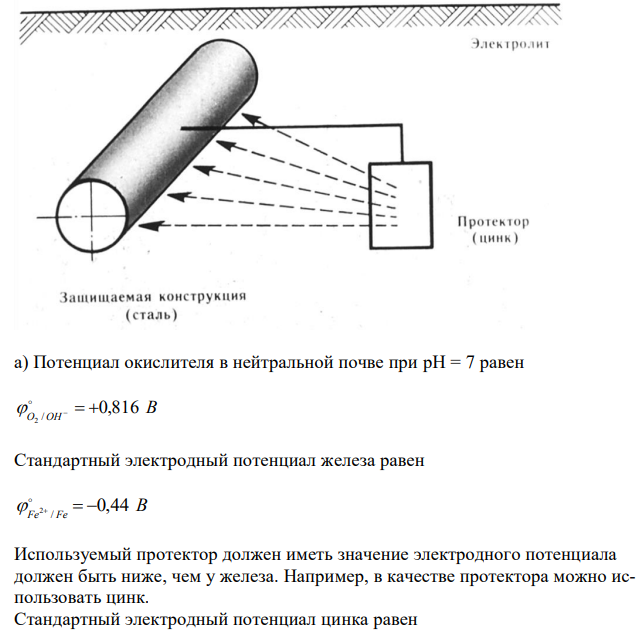
Приведите электрохимическую схему протекторной и катодной защиты стальной конструкции в условиях: а) нейтральной почвы (O2, H2O), pH = 7; б) в среде электролита (pH = 3) без доступа O2. Ответ подтвердите уравненииями соответствующих процессов и расчетами.(+ схемы и реакции)
Решение Сущность протекторной защиты заключается в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных изделий обычно используют магний, алюминий, цинк и их сплавы. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения конструкцию. 67 а) Потенциал окислителя в нейтральной почве при pH = 7 равен В O OH 0,816 / 2 Стандартный электродный потенциал железа равен В Fe Fe 0,44 / 2 Используемый протектор должен иметь значение электродного потенциала должен быть ниже, чем у железа. Например, в качестве протектора можно использовать цинк. Стандартный электродный потенциал цинка равен В Zn Zn 0,763 / 2 Записываем уравнения анодно-катодных процессов 2 A: Zn 2e Zn K : 2H2O O2 4e 4OH Суммарно 2 2 2 2Zn 2H O O Zn(OH)


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Вычислить электродные потенциалы положительного и отрицательного электродов и ЭДС гальванического элемента. Zn|ZnSO4 (0,01 М) || ZnSO4 (2,0 М)|Zn
- Вычислите эквивалентную массу: 1.2.1. азота в оксидах N2O, NO, NO2
- Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы. Задача 37
- Образование сероводорода из простых веществ протекает по уравнению Н2(г) + S(ромб.) = Н2S(г); Н = -20,15 кДж.
- Определите массу оксида алюминия которая может быть получена на 23,4 гидроксида алюминия, если выход реакции составляет 92 % от теоретически возможного.
- Обоснуйте испытание сульфадиметоксина по показателю «Сульфаты» в соответствии с требованиями ФС.2.1.0180.18 (Приложения № 3, 7).
- Дайте обоснованный ответ, в каком направлении может самопроизвольно протекать заданная реакция? Pb
- Определите простейшую формулу вещества, если оно содержит (по массе): 1.3.1. 18,28 % лития, 71,09 % алюминия и 10,62 % водорода
- Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы. Задача 27
- К каждому из веществ: гидрокарбонат калия, уксусная кислота, сульфат никеля, сульфид натрия прибавили раствор серной кислоты.
