| 🎓 Заказ №: 22227 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Причины и условия возникновения свободной поверхностной энергии, способы ее уменьшения и увеличения; взаимосвязь Gпов c поверхностным натяжением. 23 б. Составьте формулу мицеллы золя, образующегося в реакционной смеси, данной в таблице. Изобразите схему строения мицеллы. Определите заряд коллоидной частицы и укажите факторы, с помощью которых можно разрушить коллоидный раствор.
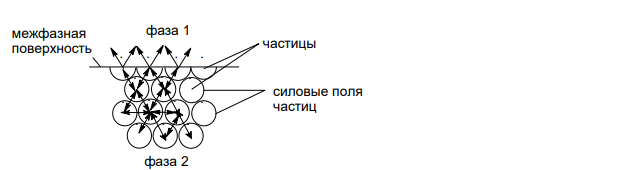
Решение: а. Между частицами любого вещества действуют различные молекулярные силы. Коге-зионные силы между частицами, находящимися внутри каждой отдельной фазы, ском-пенсированы между собой, в результате в объеме фазы возникает насыщенное силовое поле: В отличие от этого, на межфазной поверхности взаимодействуют неодинаковые по сос-таву и строению частицы разных фаз, поэтому их молекулярные силы нескомпенсиро-ваны. В результате на поверхности раздела возникает ненасыщенное силовое поле, а находящиеся на ней частицы обладают большей энергией, чем частицы внутри каждой из фаз. Избыточная свободная энергия, возникающая на межфазной поверхности в изобарно-изотермических условиях, называется свободной поверхностной энергией Гиббса ( Gпов ). Вследствие этого общая энергия Гиббса гетерогенных систем больше, чем у гомогенных на величину Gпов : G Gфазы 1 Gфазы 2 Gпов Свободная поверхностная энергия пропорциональна площади поверхности раздела фаз Gпов S где удельная свободная поверхностная энергия, то есть энергия, приходящаяся на единицу поверхности раздела фаз (Дж/м2 ). Если одна из фаз гетерогенной системы является жидкой, то называется поверхностным натяжением. Удельная поверхностная энергия, или поверхностное натяжение представляет собой сумму механической работы обратимого образования единицы площади поверхности и поглощаемой при этом теплоты. Любой процесс протекает самопроизвольно, если он приводит к уменьшению свободной энергии системы. В соответствии с этим снижение Gпов в гетерогенных дисперсных системах также происходит в результате самопроизвольно протекающих процессов. В соответствии с уравнением Gпов S уменьшение свободной поверхностной энергии может быть достигнуто двумя путями: – за счет уменьшения межфазной поверхности, то есть снижения дисперсности; – за счет уменьшения поверхностного натяжения в результате поверхностных явлений (смачивания и сорбции ПАВ на поверхности раздела фаз). Свободная поверхностная энергия может быть увеличена в результате увеличения дисперсности и увеличения поверхностного натяжения (например, за счет десорбции ПАВ).


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- При действии на карбонат кальция массой 5 г соляной кислотой (кислота в избытке) образовался хлорид кальция массой 4,5 г.
- Сколько потребуется концентрированной азотной кислоты с плотностью 1,41 г/см3 для приготовления 500 см3 0,2 н. раствора.
- На чем основан метод нефелометрии?
- Равновесие системы СО(г) + Н2О (г) СО2(г) + Н2(г) установилось при следующих концентрациях (моль/л): [СО] = 0,004; [Н2О] = 0,064; [СО2] = 0,016; [H2] = 0,016.
- На основании строения атома укажите, какую роль окислителя или восстановителя в ОВР проявляют выделенные элементы в соединениях Na2O2, KClO3.
- В какой пробирке происходит реакция при внесении цинковых пластинок в растворы нитрата алюминия и сульфата железа ?
- К 200 мл 10 %-го раствора NaOH (ρ= 1,12 г/мл) добавили 200 мл воды.
- Дана схема реакции: H2 S KMnO4 MnO2 S KOH H2O 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции; 2) составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;3) запишите множители в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты; 4) подберите стехиометрические коэффициенты остальных участников реакции; 5) выпишите формулы вещества – окислителя и восстановителя, рассчитайте их молярные массы эквивалентов.
- Что представляет собой показатель титрования?
- Сколько г H2SO4 содержится в 1 см3 0,1 н. раствора?
