| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
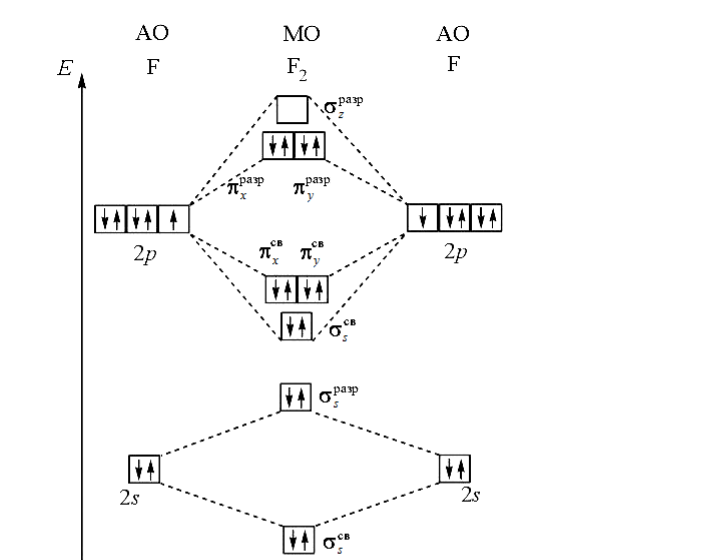
Распределите валентные электроны молекулы фтора по энергетической диаграмме молекулярных орбиталей двухатомных молекул 2-го периода. Определите порядок связи в молекуле. Обладает ли молекула фтора магнитными свойствами? 43б. Согласно теории валентных связей в образовании ковалентных связей могут принимать участие одноэлектронные облака (один из механизмов образования ковалентной связи). Опишите данный механизм на примере образования ковалентной связи между атомами фтора. Определите пространственную конфигурацию молекулы OF2, используя модель отталкивания электронных пар.
Решение: а) В методе молекулярных орбиталей молекула рассматривается как единая система, содержащая ядра и электроны. При образовании молекулы возникают молекулярные орбитали двух видов – связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона молекулярную орбиталь сопровождается уменьшением энергии, то такая молекулярная орбиталь будет связывающей, если повышением энергии, то – разрыхляющей. Порядок размещения электронов по молекулярным орбиталям: прежде всего заполняются орбитали с низкой энергией, заполнение орбиталей подчиняется принципу Паули и правилу Хунда. Молекула фтора состоит из двух атомов, в ней 18 электронов. Записываем реакцию образования молекулы F2 из атомов фтора и распределение электронов соединяющихся атомов на молекулярных орбиталях: 2 2 2 2 2 2 2 2 2 1 2 2 1 2 2 5 2 [1 2 2 ] ( ) ( ) ( ) ( ) ( ) ( ) св p св p разр s св s разр s св s x y F s s p F 2 2 2 2 2 2 ( ) ( ) ( ) разр p разр p св pz y z Данная форма записи точнее отражает строение молекулы фтора. На связывающих орбиталях находится электронов 10, на разрыхляющих 8 электронов. Порядок связи равен полуразности числа связывающих и разрыхляющих электронов. 1 2 10 8 2 Nсв Nразр n Поскольку отсутствуют неспаренные электроны, то молекула фтора обладает диамагнитными свойствами. При образовании молекулы фтора каждый из двух атомов предоставляет для образования связи один неспаренный p-электрон. б) Электронная конфигурация атома кислорода 2 2 4 😯 1s 2s 2p Электронно-графическая формула атома кислорода (распределение электронов по квантовым ячейкам) Электронная конфигурация атома фтора 2 2 5 9 F 1s 2s 2p Электронно-графическая формула атома фтора Атом кислорода находится в состоянии sp3 -гибридизации. На двух гибридизованных орбиталях находятся по две пары электронов, ещё на двух орбиталях находятся по одному неспаренному электрону. Из-за неравномерного отталкивания данных орбиталей форма молекулы OF2 – искаженный тетраэдр. Угол F-O-F равен 104º.



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,6 ммоль экв/л?
- Написать в ионном и молекулярном виде уравнения реакций гидролиза (I ступень) следующих солей: сульфида кальция и нитрата цинка
- Структура судебно-медицинской службы РФ. Основные функции Бюро СМЭ.
- Как протекает атмосферная коррозия изделия из железа с кадмиевым покрытием в случае нарушения герметичности последнего?
- Чему равна растворимость в воде гидроксида хрома (III), если произведение растворимости ПР(Cr(OH)3) = 5,4∙10-31
- Подсчитав G298 реакции на основании H298 и S298 реагирующих веществ, определите возможность протекания реакции ( ) 3 ( ) 2 ( ) 4 ( ) 2 5 2 3 2 P O к H O ж PH г O г при стандартных условиях H кДж моль P O к 1549,19 / 0 2 5 ; S Дж моль K P O к 136,08 / 0 2 5 ; H кДж моль PH г 16,17 / 0 3 ; S Дж моль K PH г 211,02 / 0 3 .
- Выявить, какое вещество является окислителем, а какое – восстановителем, составить уравнения электронного баланса и расставить коэффициенты в приведенных ниже уравнениях окислительно-восстановительных реакций. а) H2S + HNO3 → H2SO4 + NO + H2O; б) H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O.
- Отметьте электродные потенциалы, укажите знаки полюсов и вычислите ЭДС химических цепей, составленных из стандартных электродов
- Через раствор электролита пропустили ток силой xA в течение y минут
- Напишите молекулярные и ионные уравнения реакций гидролиза ацетата натрия и сульфида бария
