| 🎓 Заказ №: 22175 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
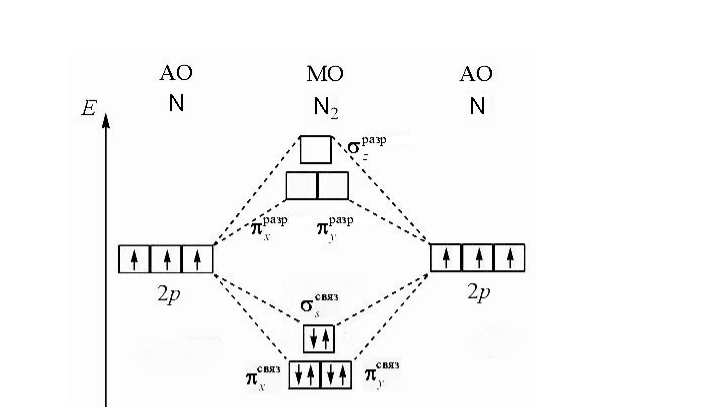
Рассматриваются молекула N2 и молекулярные ионы N2 + и N2 — . Пользуясь методом МО, объяснить образование химической связи в молекуле и в молекулярных ионах. Для молекулы изобразить энергетическую схему исходных АО и образующихся МО. Записать электронные формулы всех частиц и определить порядок связи в них. Какие частицы могут существовать, и какая из них является наиболее устойчивой.
Решение: В методе молекулярных орбиталей молекула рассматривается как единая система, содержащая ядра и электроны. При образовании молекулы возникают молекулярные орбитали двух видов – связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона молекулярную орбиталь сопровождается уменьшением энергии, то такая молекулярная орбиталь будет связывающей, если повышением энергии, то – разрыхляющей. Порядок размещения электронов по молекулярным орбиталям: прежде всего заполняются орбитали с низкой энергией, заполнение орбиталей подчиняется принципу Паули и правилу Хунда. В методе молекулярных орбиталей используется понятие о порядке связи (ПС): ПС = (Nсв-Nразр)/m , где: Nсв – количество электронов на связывающих молекулярных орбиталях, Nразр – количество электронов на разрыхляющих молекулярных орбиталях, m – количество ядер в молекуле. Чем больше ПС, тем крепче, прочнее частица (молекула, ион, радикал). Если ПС ≤ 0, то связи вообще нет, то есть данная частица существовать не может. Построим энергетическую диаграмму для молекулы N2 Данная молекула состоит из двух атомов азота, в ней 14 электронов. Записываем реакцию образования молекулы N2 из атомов азота и распределение электронов соединяющихся атомов на молекулярных орбиталях: 2 2 2 2 2 2 2 2 2 2 2 1 2 2 1 2 2 3 2 [1 2 2 ] ( ) ( ) ( ) ( ) ( ) ( ) (



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Напишите полную электронную конфигурацию элемента, содержащего на 3d-подуровне максимальное количество неспаренных электронов.
- По указанным конфигурациям валентных электронов 2s2 ,2p1 ; 6s2 ,4f14 ,5d2 определите: а) место элемента в Периодической таблице (период, группу, подгруппу); б) распределение электронов для данного элемента по слоям; в) высшую степень окисления.
- Рассматривается образование ковалентных связей между двумя невозбужденными атомами химических элементов – электронных аналогов: Po и O.
- Напишите химическую формулу ЛС, исходя из рационального названия: [2- (Диэтиламино)-этил]-4-аминобензойной кислоты гидрохлорид.
- Напишите уравнения реакций образования следующих соединений: CaS, FeCl2, Al2O3, CsF.
- Исходя из обменного механизма образования ковалентной связи, объяснить, какой из двух атомов может проявлять валентность, равную номеру группы.
- Напишите молекулярные и ионно-молекулярные уравнения гидролиза следующих солей и укажите реакцию среды раствора: Mn (NO3)2; Na3PO3; (NH4)2CO3.
- Парацетамол (ГФ XII, ФС 42-0268-07), с.83 1.
- Валентные электроны атома химического элемента характеризуются следующим набором квантовых чисел n, l, ml и mS соответственно: 3, 2, 2, +1/2; 4, 0, 0, +1/2; 4, 0, 0, -1/2. О каком элементе идет речь?
- Написать структурные формулы следующих соединений: гидроксид магния, силикат натрия, ортофосфорная кислота, нитрит калия, оксид бериллия.
