| 🎓 Заказ №: 22198 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
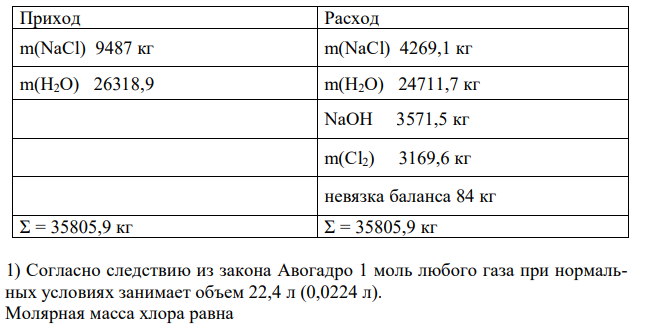
Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия: 2NaCl + 2H2O = 2NaOH + Cl2 Концентрация NaCl в растворе 310 г/л. Плотность раствора в условиях электролиза 1,17 кг/л. Степень разложения 55 %. Расчет вести на 1000 м3 хлора.
Решение: Приход Расход m(NaCl) 9487 кг m(NaCl) 4269,1 кг m(H2O) 26318,9 m(H2O) 24711,7 кг NaOH 3571,5 кг m(Cl2) 3169,6 кг невязка баланса 84 кг Σ = 35805,9 кг Σ = 35805,9 кг 1) Согласно следствию из закона Авогадро 1 моль любого газа при нормальных условиях занимает объем 22,4 л (0,0224 л). Молярная масса хлора равна

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Определите тип связи в следующих соединениях: K2S, H2S, CuCl2, N2, H2O, Fe.
- Определите класс и назовите соединения: Fe(HSO4)2, CuCl2, Cr2O3, AlOHCl2, CO2, CoO, H2MnO4, LiOH, Cr(OH)2, HIO3.
- На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите G о 298 реакции, протекающей по уравнению: 4NН3(г) + 5О2(г) = 4NО(г) + 6Н2О(г)
- Вычислить изменение стандартного изобарно-изотермического потенциала реакции 2 2( ) 2( ) 1 NO(г) O г NO г .
- Вычислите температурный коэффициент скорости некоторых реакций, если при повышении температуры: а) от 283 до 373 К скорость реакции увеличилась в 16 раз; б) от 323 до 373 К скорость реакции увеличилась в 1200 раз.
- Вычислите G о 298 для следующих реакций: а) 2NaF(к) + Cl2(г) = 2NaCl(к) + F2(г) б) PbO2(к) + 2Zn(к) = Pb(к) + 2ZnO(к)
- Вычислите тепловой эффект и напишите термохимическое уравнение ре-акции горения 1 моль этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода.
- Составить уравнение электродных реакций, протекающих при электролизе водного раствора ZnSO4.
- Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и HCl; б) Сr(ОН)3 и NaOH; в) Ва(ОН)2 и СоСl2
- Расставить коэффициенты в уравнении реакции методом электронного баланса HNO3 + HI → HIO3 + NO2 + H2O
