| 🎓 Заказ №: 22174 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Резорцин (ФС 42-3267-96), с.81 1. Растворимость в воде. 2. Реакции на подлинность с железа (III) хлоридом и гидрофталатом калия. 3. Испытание на чистоту: прозрачность, тяжелые металлы. 4. Количественное определение, хранение, применение.
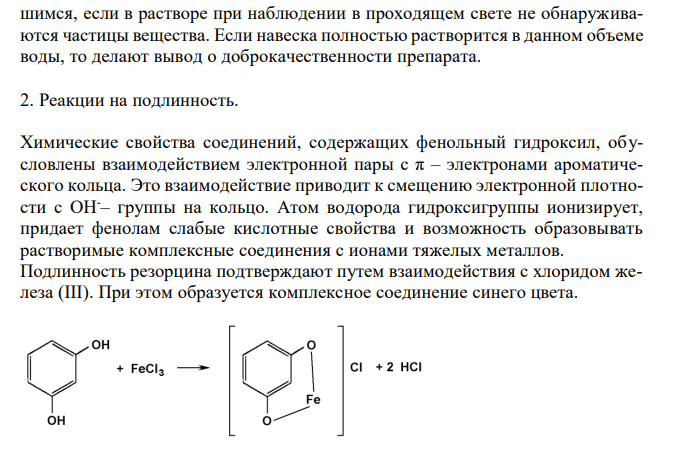
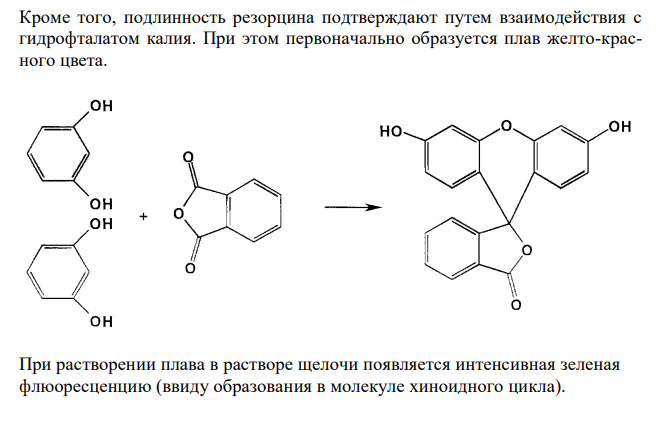
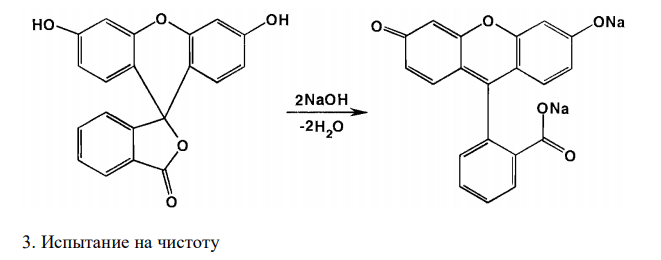
Решение: Резорцин, Resorcinum 1. Растворимость в воде. Растворимость веществ в ГФ XI выражается либо в частях, либо в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г препарата. ГФ XI допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически не растворим». Согласно ФС 42-3267-96, резорцин очень легко растворим в воде. То есть, для растворения 1 г препарата необходим объем воды до 1 мл. Для подтверждения подлинности и доброкачественности навеску предварительно растертого резорцина массой 1,00 г вносят в 1 мл воды и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. Если навеска полностью растворится в данном объеме воды, то делают вывод о доброкачественности препарата. 2. Реакции на подлинность. Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π – электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-– группы на кольцо. Атом водорода гидроксигруппы ионизирует, придает фенолам слабые кислотные свойства и возможность образовывать растворимые комплексные соединения с ионами тяжелых металлов. Подлинность резорцина подтверждают путем взаимодействия с хлоридом железа (III). При этом образуется комплексное соединение синего цвета. Кроме того, подлинность резорцина подтверждают путем взаимодействия с гидрофталатом калия. При этом первоначально образуется плав желто-красного цвета. При растворении плава в растворе щелочи появляется интенсивная зеленая флюоресценцию (ввиду образования в молекуле хиноидного цикла). 3. Испытание на чистоту


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Имеется Ni-Co гальванический элемент, концентрация электролита Co2+ равна 1 М.
- Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему?
- Определите возможность протекания процесса при стандартных условиях и при 1000 К SO2(г) + NO2(г) → SO3(г) + NO(г).
- Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
- Что такое водородный показатель (рН)? Числовые значения рН в кислом, щелочном и нейтральном растворах.
- Рассчитайте рН 4 %-го раствора HNO3 (ρ = 1,022 г/мл).
- При понижении температуры на 20 °С скорость реакции уменьшилась в 64 раза.
- Обоснуйте и приведите химизм реакций определения подлинности рибофлавина- мононуклеотида по методикам НД: — 0,2 г препарата растворяют в 20 мл воды, 10 мл этого раствора просматривают в УФ свете, наблюдается зеленая флуоресценция, исчезающая при прибавлении щелочи или кислоты; — 0,05 г препарата в 3 мл концентрированной азотной кислоты, кипятят в течение 5 минут, прибавляют 10 мл воды.
- Напишите уравнения электролитической диссоциации растворов H2SO4; LiOH; (MgOH)2SO4; Cu (HSO3)2.
- Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
