| 🎓 Заказ №: 22215 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Сделайте предварительный расчет объёма 0,05 М раствора натрия эдетата, который должен израсходоваться при количественном определении цинка сульфата по методике ФС.2.2.0036.18 (Приложение № 3). М.м. цинка сульфата гептагидрата 287,58.
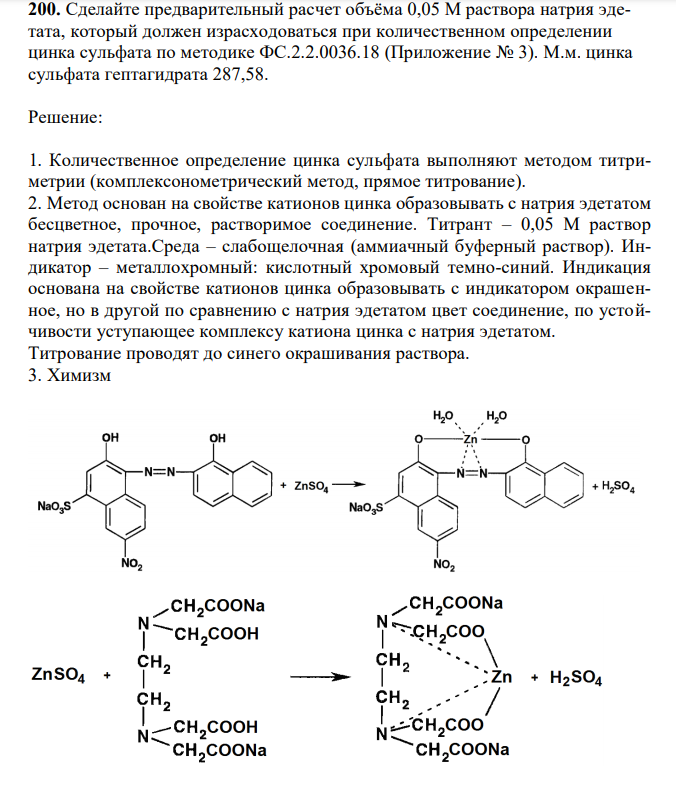
Решение 1. Количественное определение цинка сульфата выполняют методом титриметрии (комплексонометрический метод, прямое титрование). 2. Метод основан на свойстве катионов цинка образовывать с натрия эдетатом беcцветное, прочное, растворимое соединение. Титрант – 0,05 М раствор натрия эдетата.Среда – слабощелочная (аммиачный буферный раствор). Индикатор – металлохромный: кислотный хромовый темно-синий. Индикация основана на свойстве катионов цинка образовывать с индикатором окрашенное, но в другой по сравнению с натрия эдетатом цвет соединение, по устойчивости уступающее комплексу катиона цинка с натрия эдетатом. Титрование проводят до синего окрашивания раствора. 3. Химизм
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Константа равновесия реакции N2 (г) + 3 Н2 (г) ↔ 2 NН3 (г) + Q равна при некоторой температуре 2,1. Равновесные концентрации водорода и аммиака в реакционной смеси составляли: [Н2] равн. = 0,2 моль/л, [NH3]равн = 0,8 моль/л
- По значениям квантовых чисел «последнего» электрона электронной формулы (n = 3, l = 2, ml = -1, ms = +1/2) определить положение данного элемента в периодической системе. Привести электронно-графическую формулу валентного слоя этого элемента, показать с
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения Al2O3 → AlCl3 → Al(NO3)3 → Al(OH)3 → Al2O3
- Закончить уравнение реакции, записать сокращённое ионно-молекулярное CaCl2 + К3PO4 →
- Записать выражение для скорости реакции 2 NО (г) + Cl2 (г) = 2 NОCl(г). Начальные концентрации исходных веществ были равны: [NO]o = 0,8 моль/л ; [Сl2]o= 0,3 моль/л. Вычислите начальную скорость и скорость на момент, когда успеет прореагировать четверть оксида азота (II).
- Подберите коэффициенты в следующих реакциях ионно-электронным методом. Укажите окислитель и восстановитель
- Составьте уравнение реакции, используя справочные данные стандартных электродных потенциалов: а) φ o (Cr3+ / Cr2+) = — 0,41 в б) φ o (S + 2 H+ / H2S) = 0,14 в
- Напишите эмпирические формулы следующих солей.
- Обоснуйте испытание сульфагуанидина по показателю «Растворимость» (в спирте 96 %) в соответствии с требованиями ФС.2.1.0179.18
- Напишите уравнения реакций схемы превращений: CO2 ← C2H4 ← C2H6 → C2H2 → C6H6 → C6H5Cl.
