| 🎓 Заказ №: 22189 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Сколько имеется в атоме элемента электронов с орбитальным квантовым числом l?
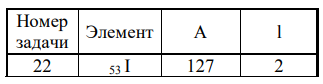
Решение: 1) Порядковый номер элемента в Периодической системе совпадает с величиной заряда ядра. Йод имеет порядковый номер в периодической таблице 53. Соответственно, заряд ядра атома йода +53. Поскольку атом в целом – нейтральная система, то сумма электронов на всех электронных оболочках атома йода равна 53. Ядро атома йода содержит 53 протона. Число нейтронов в ядре атома равно разности между массовым числом и числом протонов. В данном случае число нейтронов равно 127 – 53 = 74. 2) Электронная формула показывает количество электронов, находящихся на соответствующих орбиталях. Номер электронного уровня (соответствующий главному квантовому числу n) обозначают цифрами, после номера латинскими буквами s, p, d, f указывают подуровень, справа вверху от каждой указывают общее число электронов на данном подуровне. Электронная формула атома йода имеет вид

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Рассчитайте общую жесткость воды (ммоль/л, градусы), если в 0,15 л воды содержится 29,2 мг гидрокарбоната магния и 9,50 мг хлорида магния.
- Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
- Какой силы ток нужно пропустить через раствор серной кислоты, чтобы при 100 % выходе по току в течение 5 часов заполнить водородом сосуд емкостью 250 л при 760 мм Hg и t = 25ºC?
- Какую массу образца, содержащего около 30 % серы, необходимо взять для анализа, чтобы масса гравиметрической формы (бария сульфата) составляла 0,3 г?
- Сделать вывод о возможности протекания прямой реакции при различных температурах.
- Составить уравнения, с помощью которых можно осуществить следующие превращения: NaHCO3 → Na2CO3 → Na2O → Na2SO4 → NaOH → Cr(OH)3 → CrOHSO4
- Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 град, если температурный коэффициент скорости данной реакции равен двум?
- Дана реакция, протекающая в гальваническом элементе.
- Не производя вычислений определить будет ли SХ.Р. 0, SХ.Р. 0 или SХ.Р. 0 для процесса MgO (к) + H2 (г) = Mg (к) + H2O (ж).
- Как получают металлический натрий?
