| 🎓 Заказ №: 22173 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составить примерный план анализа при подозрении на отравление салициловой кислотой.
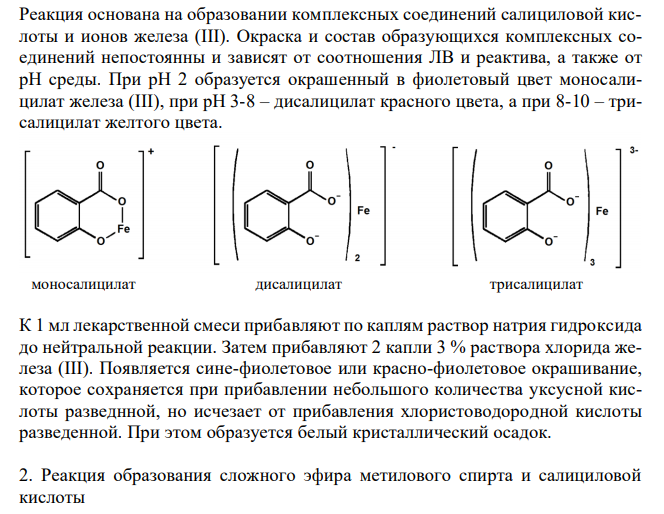
Наиболее оптимальный метод изолирования — метод Валова, этот метод используется для изолирования барбитуратов, но также подойдет для изолирования салициловой кислоты. На первом этапе при подщелачивании салициловая кислота переходит в ионизированную форму и в водную фазу, на втором этапе под действием серной кислоты диссоциация салициловой кислоты подавляется (образуется молекулярная форма) и салициловая кислота переходит в органическую фазу. 1-й этап. Измельченный объект массой 100г заливают 180 мл подщелоченной воды (рН=10) и настаивают в течение 30 мин. Щелочную вытяжку центрифугируют. Надосадочную жидкость (центрифугат) подкисляют серной кислотой до рН=2. В полученном растворе с помощью вольфрамата натрия при на-гревании осаждают белки и смесь вновь центрифугируют. 2-й этап. Барбитураты из центрифугата экстрагируют диэтиловым эфиром при значении рН=2. Эфирный слой отделяют и проводят реэкстракцию водным раствором гидроксида натрия. Щелочной водный экстракт подкисляют серной кислотой до рН=2 и барбитураты извлекают равным объемом диэтилового эфира. Такая повторная экстракция позволяет получить чистые извлечения. С хлороформным экстрактом проводят вначале проводят качественные реакции на салициловую кислоту. Качественное обнаружение салициловой кислоты 1. Цветная реакция с хлоридом железа (III) 12 Реакция основана на образовании комплексных соединений салициловой кислоты и ионов железа (III). Окраска и состав образующихся комплексных соединений непостоянны и зависят от соотношения ЛВ и реактива, а также от рН среды. При рН 2 образуется окрашенный в фиолетовый цвет моносалицилат железа (III), при рН 3-8 – дисалицилат красного цвета, а при 8-10 – трисалицилат желтого цвета. моносалицилат дисалицилат трисалицилат К 1 мл лекарственной смеси прибавляют по каплям раствор натрия гидроксида до нейтральной реакции. Затем прибавляют 2 капли 3 % раствора хлорида железа (III). Появляется сине-фиолетовое или красно-фиолетовое окрашивание, которое сохраняется при прибавлении небольшого количества уксусной кислоты разведнной, но исчезает от прибавления хлористоводородной кислоты разведенной. При этом образуется белый кристаллический осадок. 2. Реакция образования сложного эфира метилового спирта и салициловой кислоты

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление происходит при следующих превращениях: ; Mn → Mn
- Вычислите ΔHº реакции 3N2O(г) + 2NH3(г) = 4N2(г) + 3H2O(г).
- Запишите конфигурацию валентных электронов для атома 49In.
- ВЫВЕСТИ ФОРМУЛУ ВЕЩЕСТВА СОДЕРЖАЩЕГО 30%-С, 70%-Si, Mr=40
- Изобразите структурные формулы 1) 2,2,4 — триметилпентан 2) 2,3 — дибромгексан 3) 2,2 — диметилтриэтилгектан 4) 2,3,4,5 – тетраметилоктан
- Напишите электронную формулу атома 17Cl.
- Используя положение элементов IV периода (кроме 36Kr), определите, какой из элементов имеет наибольшую электроотрицательность.
- Запишите конфигурацию валентных электронов для атома 51Sb.
- На d-подуровне находятся 5 электронов.
- Не производя расчетов, определить на основании ΔSº и ΔHº, какие из приведенных ниже процессов должны протекать только при повышенных температурах: 1. N2(г) + 2 H2O(г) + ½ O2(г) = NH4NO3(тв) – 118,5 кДж; 2. 3 Ca(тв) + N(2г) = Ca3N2(тв) – 440,0 кДж; 3. С2H5OH(г) = C2H4(г) + H2O(г) – 45,5 кДж; 4. 2 PbO(тв) + C(тв) = 2 Pb(тв) + CO2(г) – 42,0 кДж.
