| 🎓 Заказ №: 22226 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Тепловой эффект реакции равен по абсолютному значению и обратен по знаку изменению энтальпии реакции. Энтальпия являются функцией состояния, то есть изменения энтальпии является разностью конечного и начального состояния системы. Находим изменение энтальпии данной реакции при стандартных условиях, используя табличные значения изменений энтальпий веществ.
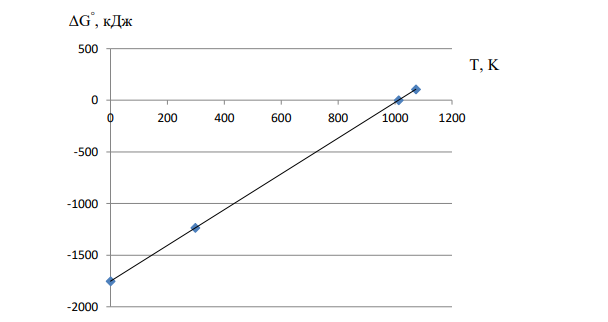
Судить о возможности протекания реакции в ту или иную сторону по величине изменения энтальпии – некорректно. Для подобной оценки необходимо вычислить величину изменения изобарно-изотермического потенциала (изменение энергии Гиббса G). Самопроизвольно протекающие процессы идут в сторону уменьшения G. Если G < 0, процесс принципиально осуществим. Если G > 0, процесс самопроизвольно проходить не может. 2. Энтропия является мерою неупорядоченности системы. Энтропия возрастает при всех процессах, в которых происходит увеличение числа частиц в системе, при процессах, связанных с ускорением движения частиц (плавление, испарение). Наоборот, процессы, в которых происходит упорядочение в системе (кристаллизация, конденсация, уменьшение числа частиц в системе), ведут к уменьшению энтропии. В ходе данной реакции из каждых 2 моль твердых и 8 моль газообразных исходных веществ образуется 2 моль твердых продуктов реакции. Количество молекул (особенно газообразных веществ) в системе уменьшается. Соответственно, уменьшается неупорядоченность в системе, S 0. 262 3. Энтропия является функцией состояния, то есть её изменение (ΔS) является разностью конечного и начального состояния системы. Находим изменение энтропии данной реакции при стандартных условиях, используя табличные значения абсолютных энтропий веществ. S 2S298 (Al2 (SO4 )3(к) ) 2S298 (Al2O3(к) ) 6S298 (SO2(г) ) 3S298 (O2(г) ) 2239,20 250,926248,07 3205,04 1727 Дж/ К 1,73 кДж/ К 0 S , то есть при протекании данной реакции происходит упорядочение системы. Изменение энтропии не даёт ответа на вопрос о направленности процесса. Однозначным критерием направленности процесса является знак изменения энергии Гиббса. Если G < 0, процесс принципиально осуществим. Если G > 0, процесс самопроизвольно проходить не может. 4. Связь изменения энергии Гиббса с изменениями энтальпии и энтропии. G H TS При T значение изменения энергии Гиббса будет постоянно возрастать в сторону положительных значений. 0 G , реакция будет протекать справа налево. При T 0 значение изменения энергии Гиббса будет стремиться к значению изменения энтальпии реакции G H То есть, 0 G , реакция будет протекать слева направо. 5. Находим изменение энергии Гиббса данной реакции при 298 K G298 1750,82298(1,73) 1235,28 кДж Поскольку 298 0 G , то делаем вывод, что данная реакция возможна при 298 К. Знак G298 определяет энтальпийный фактор. Соотношение между абсолютной температурой и температурой по шкале Цельсия T t 273 263 Находим изменение энергии Гиббса данной реакции при C 800 , пренебрегая зависимостью HT ST , от температуры T2 800 2731073 K G1073 1750,821073(1,73) 105,47 кДж Поскольку 1073 0 G , то делаем вывод, что данная реакция невозможна при 800 ºС (1073К). Знак G1073 определяет энтропийный фактор. 6. Находим температуру, при которой 0 G (температуру химического равновесия) К S H T 1012 1,73 1750,82 298 298 7. При T 0 K (теоретически) G H298 1750,82 кДж При T 298 K G 1235,28 кДж При T 1012 K G 0 кДж При T 1073 K G 105,47 кДж Строим график зависимости G от Т.





| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Электролиз водного раствора вещества X проводили с анодом из материала Y при силе тока I. X = Na2SO4
- Окислительно-восстановительные реакции протекают по приведенным схемам. Au + HNO3 + HCl → H[AuCl4] + NO + H2O
- Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства ?
- Определить молярную массу хлора, если масса 500 мл (н.у.) его равна 1,585 г.
- Вычислите массовую долю HNO3 в растворе и моляльность 8 н. раствора HNO3 , плотность которого равна 1,246 г·см-3 .
- Определите объем газа при н.у., если при 373 К и 500 кПа его объем равен 5 л.
- Осмотическое давление раствора, содержащего 3 г сахара в 250 мл раст-вора, равно 83,08 кПа при 12ºС.
- На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз (γ=2) ?
- Реакция горения ацетилена протекает по уравнению C H (г) O (г) 2CO (г) H O(ж)
- Вычислите энергию Гиббса и определите возможность протекания реакции TiCl4(г) 2Mg(т) Ti(т) 2MgCl2(т) H , кДж / моль 298 -763 0 0 -641 , /( ) S298 Дж моль К 352 32,7 30,6 90 при температурах 400 и 1600 К.
