Оглавление:








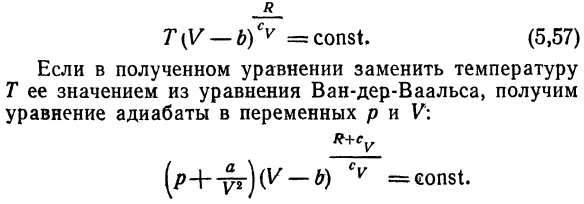



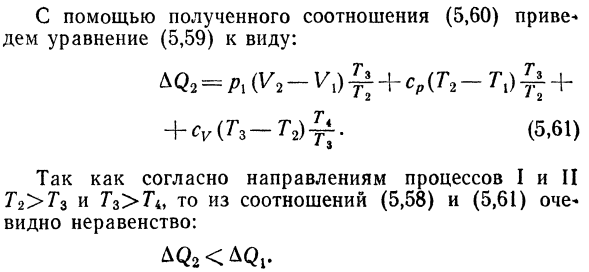

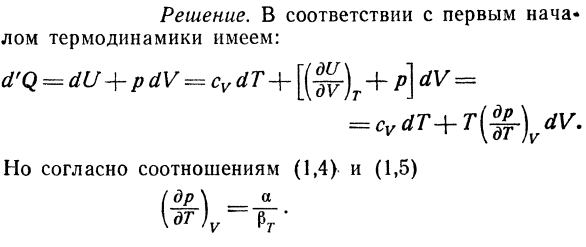

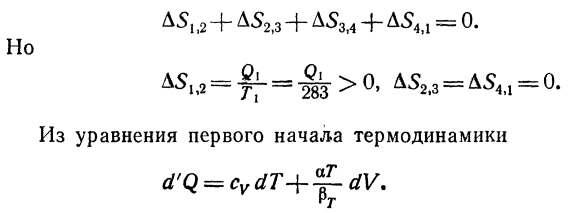

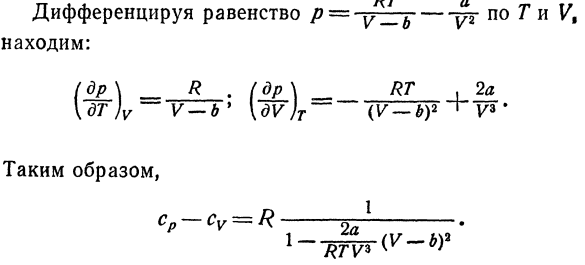
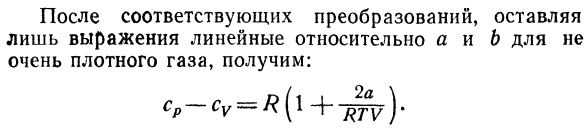

0 так называемой «тепловой смерти» вселенной.
- Непонимание Вселенной Из-за закрытой системы Теория»тепловой смерти» Вселенной. Рассматривать проблему Об энтропии замкнутой системы Изменения адиабатической энтропии равны. Ноль (обратимый процесс), или увеличение энтропии (В необратимом процессе). Отсюда, Клаузиус и другие Вывод. Когда энтропия замкнутой системы растет、
Для него возможно представить весь мир как замкнутую систему Мы также применяем неравенство dS> Ot, которое указывает на рост Энтропия всего мира. 、 Поэтому она должна привести к»Тепловой смерти» Вселенной. Действительно, 1 нагреватель и 1 Холодильник в случае реверсивного процесса делается
Последнее означает увеличение Количество энергии, которое не может быть амортизировано Используется для выполнения работы и результата Людмила Фирмаль
Соотношение: К2 * 2 в 1 Если температура нагревателя изменяется、 Или Последнее равенство、 Обеспечьте циркуляцию количества тепла, передаваемого в холодильник、 Увеличение, то есть количество девальвированных увеличивается* Энергия Ноя. Поэтому, по мнению Клаузиуса, развитие мира Обязательно движение материи в таком направлении Потеря способности к дальнейшему преобразованию
Преобразование. Энгельс написал краткое изложение этих взглядов Клаузиуса следующим образом: Пару часов пришлось заводить сначала, а потом и ежа Пока они не будут в равновесии, и Чудо снова выведет их из этого состояния. Это будет движение. Энергия, потраченная на часовой завод, исчезла Ла, по крайней мере в качественном смысле, может Он восстанавливается только внешним толчком.
- Значение Поначалу тоже надо было давить извне. Значение. Количество движения во Вселенной, или Энергия не всегда одинакова. Энергия Она была создана; это означает, что она создает так, что она Он был уничтожен. Дурацкая реклама! (Нерационально) « Теория Клаузиуса, ведущая к идее В сотворении мира нет фи, то есть в направлении идеализма Физический base. As факты показали、
Астрономические данные, мир не замкнут во Вселенной Нет ни начала, ни конца в time. So … Вывод, который распространяется на бесконечную вселенную- Для закрытых систем. То есть исходное положение теории Клауса Борода фальшивая и поэтому、 «Тепловая смерть» Вселенной ненаучна.
Вывод об увеличении энтропии справедлив, следовательно, увеличение энтропии в замкнутых системах не обосновано. Людмила Фирмаль
Затем Больцман дал статистическую интерпретацию、 Интерпретация второго закона термодинамики* Он критиковал идеалистический вывод Клаузиуса. Больцман. Из того, что бесконечная Вселенная бесконечна Бесконечное время может быть сильно отклонено Только из его среднего состояния Затем снова приблизьтесь к наиболее вероятному состоянию- Государство.
Идеи Больцмана сыграли неоценимую роль Разоблачая второе идеалистическое извращение Начало термодинамики, ее слабыми местами являются Что они говорят об абсолютном равновесии мира Система, то есть «тепловая смерть» Вселенной, и признание Любое отклонение от этого состояния является случайным. Йоакто. В дополнение к реальности, термодинамическая стимуляция、
Есть много других факторов, которые способствуют развитию природы «…К тому, что в природе, в конце концов, все будет сделано Это не метафизика, это диалектика. Вечно однородный, но не всегда повторяющийся Повторите круг и ощутите истинную историю」 (Ф. Энгельс, Анти-дуэль. Государственное политическое издательство, 1950、 С. 23).
Найти изменения энтропии тела в При надувании под постоянным давлением. Решение. У нас есть: И я думаю, что т. в < / P С учетом коэффициента расширения а-V \ ДТ) Р ’ Мы получаем: Знак этого выражения зависит от знака А. 2.Вычисление энтропии Ван дер Вагара Ван дер Бер и найти его уравнение адиабата. Решение — J-7-J
Решите уравнение ван-дер-Ваальса относительно Давление, мы получаем: Так… резюме-это слабо зависит от температуры、 Ван-дер-ван, чтобы найти адиабатическое уравнение Также дают газ, формула в, 12) В форме, используя равенство Е 25):% ) Е, 51) D’Q-Q в процессе изоляции, так что это Отношение е, 51) можно упростить следующим образом: Е, 52)
Значение, полученное из уравнения ван-дер-Ваальса, равно: 1 ^ E, 53) для газов в соответствии с уравнением ван дер Ви АРСА.: f-gXJ = 0, или cv-cv (T). Конечно, если вы думаете об энтропии s как о функции Температура температура и объем F, мы пишем, что полный Дифференциальный: Если процесс протекает в определенном объеме V = const, то дс ¦. Е, 55) \И Л / У л.
Откуда Получаем производную C y по объему при T = const Использование отношений (см. Главу 7,§ 6) (ДС_ \ \ дифференциальный клапан) Мы получаем: \ Г)Т = Т ш(ДГ / к ^ Т-5Ф \) Теплоемкость грамм-морфанделл Газ Wahl не зависит от объема. Уравнение E, 53) может быть интегрировано в следующих случаях: Определена температурная зависимость теплоемкости、 То есть Su = Su (T).Пусть газ идеален в следующем смысле ^ v — ^ const и следует уравнению ван-дер-Ваальса.
Тогда уравнение E (Интеграл 53) является уравнением* Следующие формы переменных T и V-отношения изоляции: Р — б) ТИЦ = const и Е, 57) Если мы заменим температуру полученным уравнением Получаем значение T из уравнения ван-дер-Ваальса. Например, горячая вода будет излучать то же тепло: уравнение изоляции переменных p и V Масса холодной воды и ее температура совпадают. Т-4-Т Решение. Температура смеси T=!^ «、
Изменение энтропии г т т | ^ + / 4H, d’Q ^ Так… Так как (я 4. Каждый из 2 контейнеров включен 1 моль идеального газа при температуре На самом деле, T1 и T2.Когда кровеносные сосуды вступают в контакт、 Обе субстанции получают возможность стать государственными Отсутствие равновесия из — за теплопроводящих стенок Изменение объема. 5.
Вычисляет небольшое увеличение энтропии Следующий процесс: Вода 1 грамм молекула А8 г) 100 ° С превращается в пар при 1 атм нагрейте до 650°C с p = const. Повторите А5 ^ 33 кал \ град. 6.Идеальным газом в качестве рабочего тела Участвуйте в следующих 2-х обратимых процессах. Государство/?процесс I, V \выполняется сначала с p = p \ to Состояние в состоянии pV2, то l / = V2 б)состояние от ri V1 до состояния p2, Vi = Vu Тогда p = p2 в состоянии p2, V2> значения cp и cv являются constant.
To нагрейте его.、 Те, о которых сообщается системе в этих 2 процессах, отличаются. Изменения в аятолле Рухолле Хомейни точно такие же. Решение. Я подумаю об этом. графически процесс без потерь в диаграмме pV (Рис. 39).О Рисунок 39.График процесса Переход из состояния а в состояние Мы стоим на разных позициях.: Через тело того же веса Расширение A3 и следующее Последующий изометрический процесс
Через Солнце и изотермический Рекламный процесс путем постобработки Дуть давление Широкий постоянного тока Согласно первому закону термодинамики, величина Тепло передается идеальному газу в первом процессе ce, равный: Р г(т, — Т2). Е, 58) Аналогично, 2-й процесс можно описать следующим образом: резюме (та-Т1)+ п-ТХ. Е, 59)
Преобразует уравнение AQ2. Из закона Чарльза о равновесиях BC и AD, квази* Прочитайте соотношение: Откуда 。?L_Za » Пи-/ я__ / > 2 ^ 3 P2 TA * Тг ТХ Е, 60) Используя полученную зависимость E, 60) форма уравнения dem E, 59): + ТИЦ(Тр-Т2)^. Е, 61) В соответствии с инструкциями по процессу I и II От Г2>Г3 и Г3>Г4, то отношение Е, 58)и Е, 61) Я вижу неравенство.: ^ К2 <^ КЖ.
Вычисляет увеличение энтропии интереса Процесс. Первый случай 2-й случай \ 4 Полученная формула и соотношение е, 60) ASi = A52, то есть это указывает на изменение энтропии обоих Процесс точно такой же. 7.Найти универсальное выражение Функции, определяемые уравнениями f (((t, t, m) и f2 (t, t, t, t) Е 27)е 28)идеальные случаи газа. Повторите фдж (rtfφ, м)=〜/?、
8 .Коэффициент объемного расширения Вода при 4 ° С меняет знак и становится 0°< / 4°С Отрицательное значение. Показать содержимое Диапазон температур воды при сжатии теплоизоляции Он охлаждается, но не нагревается, как все газы и прочее Жидкость. Решение. Согласно началу первого Отбросьте термодинамику, которую мы имеем: Но отношения{1LU и A, 5)/ Ноль Рисунок 40.
График цикла Карно В воде как рабочий Вещество. С Так… Потому что в процессе изоляции, d’q = 0、 ДТ = Т —% — дв. Из этого следует, что вода в диапазоне 0°C < / <4°C、 Если она<0, то адиабатическое сжатие (dV <0) Охлаждение (dT <0). 9, показывая температуру?= Не 4°C* Достижимо при охлаждении с ЛДА Адиабатическое расширение. Решение.
Рассмотрим цикл Карно Кроме того, рабочим веществом является вода(рис. 40)、 Температура подогревателя 7 * 1-283°к * 810 ° к, холодильник Г2 = 277OK = 4°с Цикл φ—^ = 0 или D51 / 2 + D52. 3 + D53> 4 + D54 / 1-0. Но… Из уравнения первого закона термодинамики, для изотермического процесса при 4°C, Когда a = 0、 Так что это будет d’q = 0.И так оно и есть.、 Подобный этому Это противоречит второму закону термодинамики.
Поэтому температура при охлаждении составляет 4°C Вода из-за недостаточного адиабатического расширения Что это за лекарство? 10.Рассчитайте разность газов cp-cv、 Следуйте уравнению ван-дер-Ваальса. Решение с использованием соотношения Е, 25) И A, 3), разница в теплоемкости cp-cvСледующим образом: лдв \ — (ДП \ \ др)Т \ DV) Т RT p Равенство по отношению к Γ/?= = Г ^ Б、 Мы это выясним: (д-р \ _ р (р \ _ РТ.2а [ДТ)в-в-б * \ дв} т — (в-лю — ^ К3# Поэтому, после соответствующего преобразования、 только линейные выражения относительно не для A и B Газ очень высокой плотности, получаем:
Смотрите также:
Решение задач по термодинамике
| Статистический характер второго начала термодинамики. | Термодинамика и проблемы излучения |
| Энтропия и вероятность. | Закон Кирхгофа. |
