Оглавление:





Описание реакций фазовых равновесий
Одномерные реакции. Анализ фазовых диаграмм различных типов бинарных систем для обобщения изображения фазовых равновесий и регистрации фазовых переходов в виде реакций. Реакции фазового превращения указывают на начальную фазу, которая вступает во взаимодействие, или новую фазу, которая образуется после окончания фазового превращения.
Изменения температурного диапазона конверсии и химического состава фаз в процессе конверсии.
Фазовое равновесие конкретного сплава с температурой представлено комбинацией двух точек a и b на линии диаграммы, разделяющей эту двухфазную область и соединенной изотермой AB (см. Рисунок 1).
Согласно правилу фаз Гиббса, такое фазовое превращение является одномерным (C = 1). То есть вы можете изменить температуру или концентрацию, не нарушая баланс системы. Реакция фазового равновесия описывается как: t1-t2Ф1ФФ2. Где Ф1 — начальная фаза. 2 Недавно сформированная фаза. t1 и t2 — начальная и конечная температуры конверсии.
Начальная фаза может быть жидкостью (жидкий металл или жидкий раствор), новой фазой — жидким раствором другого состава или твердой фазой (компонент, твердый раствор, промежуточная фаза). Рассмотрим существующую деформацию двухфазного равновесия и ее реакцию. Равновесная реакция обозначена двойной стрелкой, а направление фазового перехода обозначено одной стрелкой. 1) Разделение жидких растворов: F ‘↔F’ », F ‘и F’ » — жидкие растворы с различным химическим составом (см. Рисунки 1.3 и 1.4). 2)
Твердофазная кристаллизация из жидкости: 液体, где Ф — компонент, твердый раствор или соединение (промежуточная фаза). 3) Многофазное превращение: Ф↔Ф (см. Рис. 1.3, 1.5, 1.6); 4) Частичное разложение твердого раствора или промежуточной фазы: 6 Ф 1-2 (см. Рис. 1.3-1.6). Где Ф1 — граничный твердый раствор или промежуточная фаза переменного состава. F2-компонент, твердый раствор, соединение (промежуточная фаза); 5) Разделение твердого раствора: Ф ‘↔Ф’, где Ф, » -1 твердый раствор с различным химическим составом различной кристаллической структуры (см. Рис. 1.5); 6)
- Преобразование из беспорядка в порядок и наоборот: неупорядоченные и упорядоченные стадии. Равновесие трех фаз инвариантной бинарной системы представляется суммой трех точек на изотерме. Две точки являются крайними и три находятся между ними (рисунок 1.2). Рисунок 1.2.
- Трехфазные равновесия и схема реакции. Согласно закону Гиббса, такое фазовое превращение является инвариантным (C = 0). Другими словами, химический состав всех равновесных фаз не меняется при постоянной температуре. Все трехфазные равновесия могут быть сведены к двум типам: эвтектическому и перитектическому. 7, где C1, C2 и C3 представляют собой химические составы соответствующих фаз.
В первом случае охлаждение из одной фазы (жидкого или твердого раствора) образует две новые фазы: жидкий раствор, компонент, твердый раствор или соединение (промежуточная фаза). Во-вторых, фаза формируется из двух взаимодействующих фаз. Начальная стадия представляет собой жидкий раствор, компонент, твердый раствор или соединение, а новая стадия представляет собой твердый раствор или соединение.
В некоторых случаях на фазовой диаграмме одна фаза (середина трехфазного равновесия) по химическому составу может быть похожа на другую фазу (одну из крайних горизонтальных точек). Такое фазовое превращение называется вырождением, и тип равновесия определяется путем сравнения температуры фазового превращения с температурой плавления компонентов (см. Рисунки 1.3 и 1.4).
Рассмотрим фазовый переход, при котором две фазы образуются из одной (тип I), включающей как жидкую фазу, так и две твердые фазы. 1) Эвтектическая трансформация: Ж↔Ф1 + Ф2 (см. Рис. 1.6). При охлаждении из жидкого раствора одновременно кристаллизуются две твердые фазы постоянного состава (компоненты Ф1 и Ф2, твердый раствор, промежуточная фаза).
Физико-химическая смесь двух фаз, образующихся при кристаллизации из раствора, называется эвтектикой.
Эвтектическая трансформация происходит во многих системах. Например, Pb — Bi, Pb — Sb. Al-Si, Al-Sn; Cd-Zn, Sb-Ge и др. Сплавы, содержащие эвтектику, обладают хорошей текучестью и чаще всего используются в качестве литейных сплавов. 2) Превращение кварца: F′↔F ′ ′ + F, где F ′, F ″ — жидкие растворы, F-компоненты, твердые растворы или мезофазы различного химического состава (см. Рис. 1.3). В системе Se, содержащей Cd, Pb, Ga и Bi, наблюдается ортоморфное превращение. Cu, в том числе V, Nb и др.,
Используется при разработке технических процессов обогащения и извлечения цветных металлов из промежуточных продуктов сгорания мультиметаллических руд. 3) Метатехническое преобразование: Ф1↔Ж + Ф2, где Ф1-Граничный твердый раствор или переменный состав промежуточной фазы. F2-компонент, твердый раствор, соединение (промежуточная фаза); 5) Разделение твердого раствора: Ф ‘↔Ф’, где Ф, » -1 твердый раствор с различным химическим составом различной кристаллической структуры (см. Рис. 1.5); 6) «Преобразование из беспорядка в порядок» и наоборот: «,» и «» — неупорядоченные и упорядоченные стадии. 1.3.2.
Равновесие трех фаз инвариантной бинарной системы представляется суммой трех точек на изотерме. Две точки являются крайними и три находятся между ними (рисунок 1.2). Рисунок 1.2. Трехфазные равновесия и схема реакции. Согласно закону Гиббса, такое фазовое превращение является инвариантным (C = 0). Другими словами, химический состав всех равновесных фаз не меняется при постоянной температуре.
Все трехфазные равновесия могут быть сведены к двум типам: эвтектическому и перитектическому. 7, где C1, C2 и C3 представляют собой химические составы соответствующих фаз. В первом случае охлаждение из одной фазы (жидкого или твердого раствора) образует две новые фазы: жидкий раствор, компонент, твердый раствор или соединение (промежуточная фаза). Во-вторых, фаза формируется из двух взаимодействующих фаз.
Начальная стадия представляет собой жидкий раствор, компонент, твердый раствор или соединение, а новая стадия представляет собой твердый раствор или соединение. В некоторых случаях на фазовой диаграмме одна фаза (середина трехфазного равновесия) по химическому составу может быть похожа на другую фазу (одну из крайних горизонтальных точек).
- Такое фазовое превращение называется вырождением, и тип равновесия определяется путем сравнения температуры фазового превращения с температурой плавления компонентов (см. Рисунки 1.3 и 1.4). Рассмотрим фазовый переход, при котором две фазы образуются из одной (тип I), включающей как жидкую фазу, так и две твердые фазы. 1) Эвтектическая трансформация: Ж↔Ф1 + Ф2 (см. Рис. 1.6). При охлаждении из жидкого раствора одновременно кристаллизуются две твердые фазы постоянного состава (компоненты Ф1 и Ф2, твердый раствор, промежуточная фаза). Физико-химическая смесь двух фаз, образующихся при кристаллизации из раствора, называется эвтектикой.
- Эвтектическая трансформация происходит во многих системах. Например, Pb — Bi, Pb — Sb. Al-Si, Al-Sn; Cd-Zn, Sb-Ge и др. Сплавы, содержащие эвтектику, обладают хорошей текучестью и чаще всего используются в качестве литейных сплавов. 2) Превращение кварца: F′↔F ′ ′ + F, где F ′, F ″ — жидкие растворы, F-компоненты, твердые растворы или мезофазы различного химического состава (см. Рис. 1.3). В системе Se, содержащей Cd, Pb, Ga и Bi, наблюдается ортоморфное превращение. Cu, в том числе V, Nb и др.,
Используется при разработке технических процессов обогащения и извлечения цветных металлов из промежуточных продуктов сгорания мультиметаллических руд. 3) Метатактическое преобразование: Ф1↔Ж + Ф2, где Ф1 — граничный твердый раствор или промежуточная фаза, Ж — жидкий раствор, а Ф2 — твердый раствор или промежуточная фаза (см. Рис. 1.6). Примеры включают Ag-Li, Cu-Sn, Fe-Zn, Mn и Cu, In. 4) Эвтектоидное превращение или полное разложение твердого раствора: F1↔Ф2 + Ф3, где Ф1 — граничный твердый раствор или промежуточная фаза, Ф2, Ф3 — компоненты, твердый раствор и промежуточная фаза (см. Рис. 1.3).
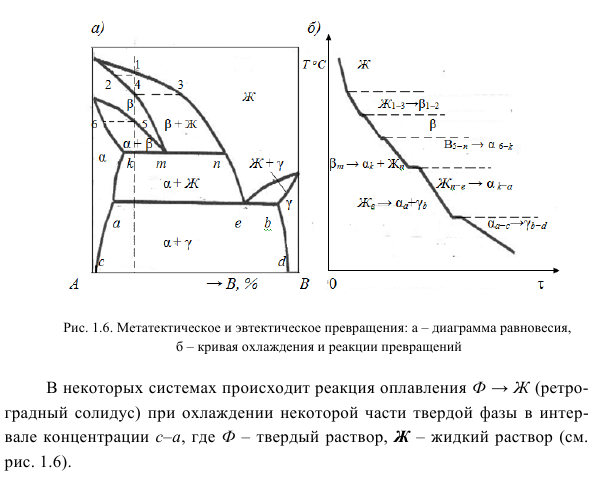
Тонкая физико-химическая смесь двух фаз, образующаяся при разложении твердого раствора, называется эвтектоидом. Эвтектоидные превращения происходят во многих системах и используются для упрочнения сплавов, особенно на основе Fe и Ti. 5) Преобразование монотектоидов: F1 ‘↔F1’ ‘+ F2, где F1’ и F1 » — твердые растворы различного химического состава, F2 — твердый раствор или промежуточная фаза.
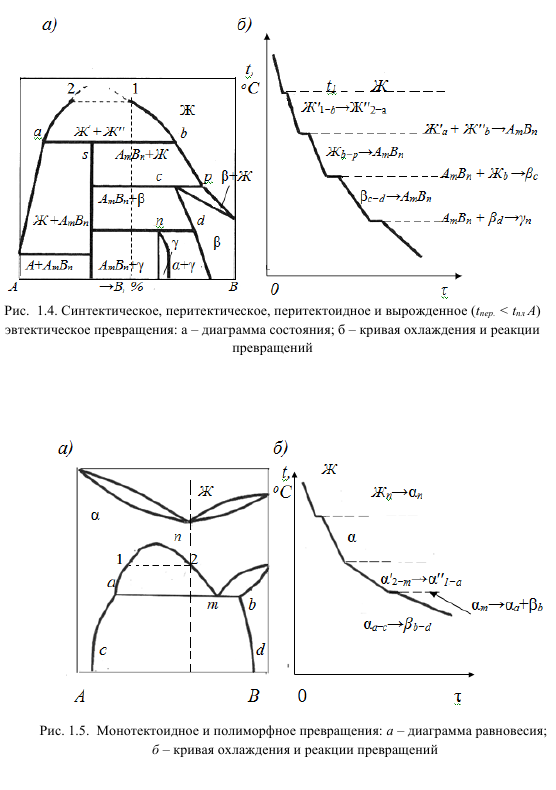
Монотектоидное превращение связано с разделением твердого раствора и обнаруживается в системе Al-Zn и Zr, содержащих Hf, U и Th. Sc — Ti, Fe — Ni; Zr c Th, U и т. Д. (Рис. 1.5). Рассмотрим фазовое преобразование типа II с образованием новой фазы из двух взаимодействующих фаз: 1) Синтаксическое преобразование: (см. Рисунок 1.4). Используемый в In-Rb, Ca-K, Fe-O и других системах, разделение жидкости также используется в технических процессах для извлечения цветных металлов. 2) Перитектическое преобразование: W + F1↔Ф2 (см. Рисунок 1.4).
Когда жидкий раствор взаимодействует с твердой фазой (компонент, твердый раствор или промежуточная фаза), образуется новая фаза (твердый раствор, соединение или промежуточная фаза). Его можно найти во многих системах, таких как Pt c W, Ag, Ru. Ti c W, Os; Au — Bi et al. 3) Преобразование перитероида: F1 + Ф2 ↔Ф 3 (см. Рисунок 1.4). Фазы Ф1 и Ф2 могут содержать ингредиенты, твердые растворы F3 представляет собой соединение или мезофазу. Найдено во многих системах: Mn-Au, Mn-C; Zr-Al, Co-V и др.
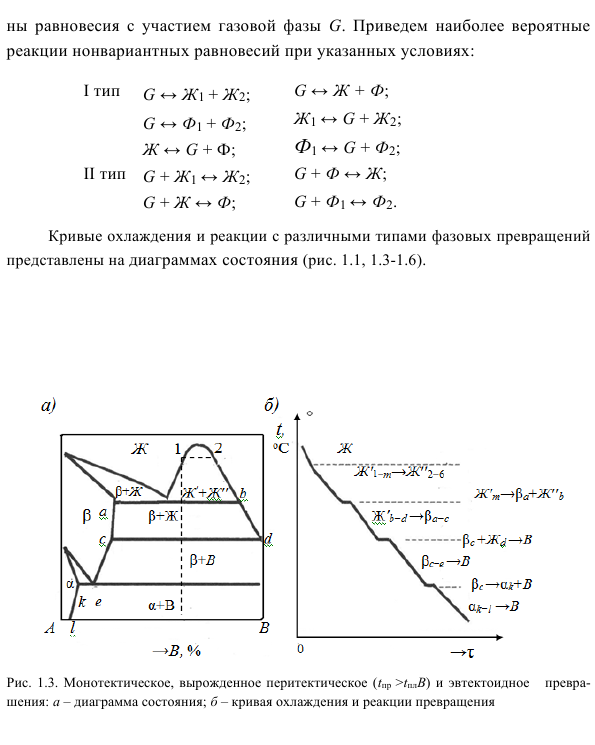
Равновесие с участием газовой фазы G возможно, когда система рассматривается в системах с низким давлением или высокой температурой (выше 2000 ° C) и металлическими газами. При определенных условиях: Реакции с кривыми охлаждения и различными типами фазовых превращений показаны на фазовой диаграмме (рис. 1.1, 1.3-1.6). Рисунок 1.3.
Биклиническое, вырожденное перитектическое и эвтектоидное превращение: диаграмма a-фазы, кривая b-охлаждения и реакция превращения I типа Рисунок 1.4. Синтез, перитектика, перителоид, вырожденная эвтектическая трансформация: фазовая диаграмма. Кривая б-охлаждения и реакция конверсии 1.5. Монотектоидные и полиморфные превращения: диаграмма а-равновесия, кривая б-охлаждения и реакция.
Смотрите также:
Примеры решения задач по материаловедению
