| 🎓 Заказ №: 22183 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 203 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составить электронную формулу атомов Ba, B в стабильном и возбужденном состояниях и изобразить орбитали внешнего энергетического уровня.
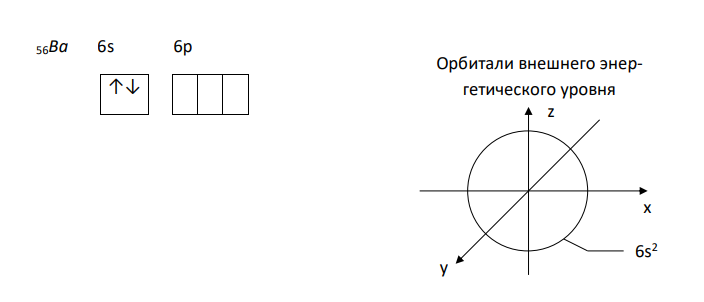
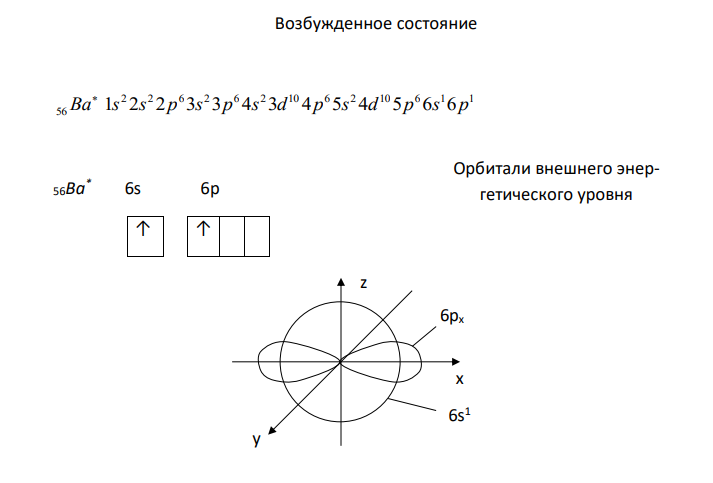
Решение: Атом бария Ba. Стабильное состояние Электронная формула 2 2 6 2 6 2 10 6 2 10 6 2 56 Ba 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 56Ba 6s 6p ↑↓ Орбитали внешнего энергетического уровня z y x 6s2 Возбужденное состояние 2 2 6 2 6 2 10 6 2 10 6 1 1 56 Ba 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 6p 56Ba* 6s 6p ↑ ↑ Орбитали внешнего энергетического уровня

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Запишите уравнения реакций получения осадков труднорастворимых солей и определите, выпадет ли осадок при смешении растворов (известным объемом 0,5 л), содержащих соответствующие ионы в концентрации 0,0001 моль/л, пользуясь приведенными значениями произведений растворимости: SrCO3, ПР = 710–10
- Определите степени окисления элементов в веществах: H2SO4, NH4NO3, H2O2, Co(OH)3, NiSO4, S, SO2
- Гальванический элемент состоит из серебра, погруженного в 0,1 М AgNO3 и цинка, погруженного в 0,01 М раствора Zn(NO3)2.
- Какие из приведенных ниже исходных веществ: а) Na2CO3 и H2SO4; б) MgCO3 и HNO3; в) KHCO3 и HCl реагируют в соответствии со следующим сокращенным ионно-молекулярным уравнением: CO H CO2 H2O 2 3 2 .
- Укажите, какие атомы окисляются, а какие восстанавливаются в указанных схемах, и определите, как изменяется их степень окисления: PbO → PbO2; NH3 → N2; V 3+ → VO2+
- Определить восстановитель и окислитель, расставить коэффициенты, пользуясь методом электронно-ионных полуреакций в следующих окислительно-восстановительных реакциях: 1. H3PO3 + AgNO3 + H2O H3PO4 + Ag + HNO3 2. NaBrO3 + NaBr + H2SO4 Br2 + Na2SO4 + H2O 3. MnO2 + KClO3 + KOH K2MnO4 + KCl + H2O
- Пользуясь правилом Гунда, распределить электроны по квантовым ячейкам, отвечающим низшему и высшему энергетическим состояниям атомов молибдена Mo, сурьмы Sb, кальция Ca.
- Написать уравнения реакций, при которых можно осуществить превращения: Na → NaOH → Na2CO3 → Na2SiO3 → NaCl
- Запишите уравнения гидролиза следующих солей и определите реакцию среды: Fe2(SO4)3, AlCl3
- Сколько атомов водорода содержится в 224 л аммиака?
