Оглавление:





Адиабатный (изоэнтропический) процесс
- Процесс теплоизоляции-это термодинамический процесс, в котором система не обменивается теплом с окружающей средой. Особенностью этого процесса является условие 0, которое должно соблюдаться на протяжении всего процесса. Практическая теплоизоляция-это не только процесс он проходит через устройство через изолированное от теплопередачи, но и может рассматриваться, например, сжатие газа в металлическом цилиндре компрессора, расширение газа при выстреле из пушки. Немедленно, нет времени для теплообмена между газом и стенкой цилиндра, чтобы произойти, и в то же время газ получает или теряет только незначительное количество тепла.
В отличие от ранее рассмотренного процесса, адиабатический процесс не может получить уравнение адиабатических процессов из уравнения состояния, так как и объем, и температура, и давление газа изменяются. Для получения уравнения адиабатического процесса воспользуемся соотношением между количеством теплоты и изменением энтропии 3. 3 1 — При 0 она равна нулю, и в процессе теплоизоляции энтропия системы не изменяется. Таким образом, адиабатический процесс является Равноэнтропийным процессом следует отметить, что это утверждение применимо только к адиабатическим процессам, обратимым при equilibrium. As описанный далее в главе 7 неравновесный адиабатический процесс является изоэнтропией.
Сочетание диффузионного и конвективного переносов массы, которое часто имеет 1 место в промышленных процессах, будет рассмотрено на следующем простом примере. Людмила Фирмаль
Если взять формулы производной энтропии 5. 4, 5. 7 или 5. 9 действительные, как указано, для любого процесса, для любого процесса и приравнять их к нулю, то уравнения адиабатического процесса получаются в разных формах с разными производными. Из Формулы 5. 9 Если уравнение делится на cp, то это уравнение образуется интегралом этого уравнения, тогда отношение мощностей cp и c считается постоянным. — Л 5. 25 С Ч АС- СОП81 p v1 1Н р — к 1П Р — СОП 1 И напоследок уу sop81. 5. 26 Отношение теплоемкости — называется изоляционным гелем, обозначаемым идеальным газом. Уравнение 5. 26 является адиабатическим уравнением координат p, v.
Величина постоянной определяется значениями давления и объема в любой точке процесса. Р р — 1 сопи Это уравнение показывает зависимость между объемами давления в адиабатическом процессе. Один Адиабатические уравнения переменных g, y выводятся из уравнения 5. 26, если давление присваивается ему в соответствии с уравнениями Клапейрона. В Или Путем деления на 7 сопз Г — Гг г г1 — 5. 2 Из этого мы можем видеть связь между температурой и объемом в начале и в конце процесса. Если заменить объем уравнения 5. 26 на температуру и давление, то получим уравнение изоляции с переменной a y. П У у sopz1 Или уменьшите для извлечения корней порядка 6 1-й-1 Д-1 Тр 4 константный. — 71 П1. 5.
- Соотношение температуры и давления в процессе 5. 31. Рассчитана газовая работа процесса изоляции 2 Согласно формуле 3. 2 Грс1у, давление выражается Прогнозируется по объему согласно уравнению 5. 26 К 055 1 п — ое Я П gk 1-В41 — При преобразовании результирующего выражения его можно представить в следующем виде 6-32. Он представлен заменой 1 через отношение 5. 29 Справляясь с перепадами температуры 1-мВ КР- 5. 33 Соотношение температур может быть заменено соотношением 5.
После чего работа процесса теплоизоляции представляется изменением давления. В уравнениях 5. 34 5. 32, 5. 33, и 5. 34, продукт p, o1 может быть заменен ct. Если эта замена производится для выражения 5. 33 Если сравнить уравнение 5. 35 с формулой изменения внутренней энергии di cn 7 2 — a, то можно увидеть, что они различаются только по знаку. То же самое можно сказать и об уравнениях первого закона термодинамики. Количество тепла в процессе изоляции равно нулю 7ad 0, и поэтому dyad — hell. Это означает, что в процессе теплоизоляции работа системы осуществляется за счет уменьшения внутренней энергии.
Для того чтобы вывести уравнения совместного действия диффузии и конвекции в процессе переноса массы, надо знать диффузионный поток молекул через плоскость, через которую отсутствует конвективный поток (которая ориентирована вдоль потока). Людмила Фирмаль
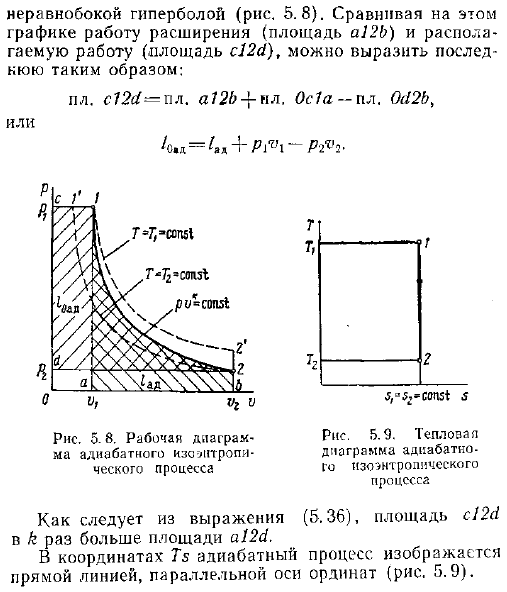
Если работа выполняется в системе 0, то прирост внутренней энергии будет равен объему работы, подаваемой в систему. Работу, имеющуюся в процессе теплоизоляции, можно увидеть, интегрируя уравнение 3. 14. Формула 3. 14 заменяет объем, представленный давлением, в соответствии с формулой 5. 26. Интегрирования и последующих преобразований Привести к выражению к-1- 5. 36 Сравнивая эту формулу одноразовой работы с формулой расширенной работы 5. 35, можно видеть, что одноразовая работа процесса изоляции в k раз больше, чем расширенная работа. В РО-диаграмме график адиабатического процесса представлено асимметричной кривой, называемой кривой неравенства рис. 5. 8.
Продолжительная работа в таком графике a12b и работы область Обнаженная, как это пл. S12s1-ЛП. А72 НЛ. 0с1а-ПЛ. 0c12b Или 4. Е 4. P1r, 1-p2. Рисунок 5. 8. Эксплуатационная схема энтропийного процесса теплоизоляции т т т т Рисунок 5. 9. Тепловая диаграмма энтропийного процесса г Как видно из Формулы 5. 36, площадь c12h равна k раз площади a12c1. В координате Т3 процесс теплоизоляции представлен прямой линией, параллельной оси ординат рис. 5.
Смотрите также:
| Изобарный процесс | Политропный процесс |
| Изотермный процесс | Прямые циклы |
