Оглавление:




АТОМНО-КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА МЕТАЛЛОВ
- Атомно-кристаллическая структура Металл. Д. и 76 из всех элементов периодической системы Менделеева являются металлами. Все металлы имеют общие свойства, отличающие их от других веществ. Это связано с особенностями внутриатомной структуры. Согласно современным теориям строения атомов, каждый атом представляет собой сложную систему, состоящую из положительно заряженных ядер, вокруг которых схематично могут быть представлены отрицательно заряженные электроны, движущиеся на разные расстояния.
Притягательное воздействие ядра на внешние (валентные) электроны металла в значительной степени компенсируется электронами внутренней оболочки. Таким образом, валентные электроны легко смещаются и свободно перемещаются между образующимися положительно заряженными ионами.
Слабая связь отдельных электронов с остальными атомами характерна для атомов металлических веществ, что определяет их химические, физические и механические свойства. Людмила Фирмаль
Общее число электронов, связанных с конкретным атомом разных металлов ns, не одинаково. Этим объясняется довольно большая разница в степени «металлизации» отдельных металлов. Присутствие электронного газа также объясняет особые межатомные связи, присущие металлам. Металлический тип связи характеризуется тем, что между решеткой положительно заряженных ионов и окружающими ее свободными валентными электронами возникает электростатическое притяжение. Наличие металлических связей в металле придает ему ряд характерных свойств.
Высокая теплопроводность и электропроводность. Пластическая деформационная способность; термоэмиссия, т. е. способность испускать электроны при нагревании; хорошо reflectivity. It имеет металлический блеск и непрозрачен. Положительный температурный коэффициент электрического сопротивления, то есть, повышение температуры, увеличивает электрическое сопротивление металла. Поскольку последние свойства присущи только металлам, они являются: Металлы — это вещества, имеющие положительный температурный коэффициент соединения и электрическое сопротивление типа металла.
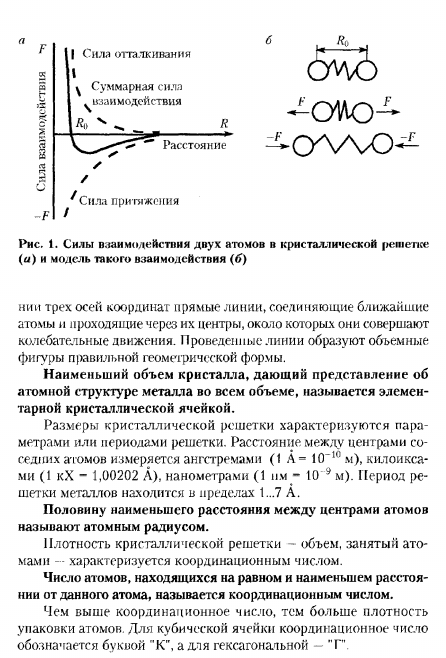
Прочность связи металла определяется отношением силы отталкивания к силе притяжения между ионами и электронами. Бревна (ионы) располагаются на таких расстояниях друг от друга, чтобы энергия взаимодействия была минимальной(Рис.1). Приближение атома(Иона) к расстоянию меньшему, чем R, или удаление атома на расстояние большее, чем Ko, возможно только при выполнении некоторой работы по отталкиванию или attraction. As в качестве модели такого взаимодействия (Рис.1, 6) возьмем 2 шарика (ионы), между которыми существует пружина (сила взаимодействия). в равновесном состоянии расстояние между шариками равно нулю.
- Когда расстояние сокращается и пружины сжимаются, между шарами появляются 100 отталкиваний ( / • ), которые стремятся вернуть шар в состояние равновесия. Когда расстояние больше, сила притяжения ( ~ / • ) равна displayed. In в связи с этим атомы в металле располагаются естественным образом на определенном расстоянии от Апвра, образуя регулярный Кристалл lattice. It следует мысленно представить ее таким образом, чтобы она проходила в направлении пространства 3 оси координат-это прямые линии, которые соединяют ближайшие атомы и проходят через центр, колеблясь вокруг его центра. Нарисованные линии образуют объемную диаграмму правильной геометрической формы. Рисунок 1.
Мощность взаимодействия 2 атомов в кристаллической решетке (s)и модель такого взаимодействия(6) — СЖ) Х Наименьший объем Кристалла, дающий представление об атомном строении металла во всем объеме, называется элементарной кристаллической ячейкой. Размеры кристаллической решетки характеризуются параметрами решетки или., пикселях Киро (1 КХ-1,00202 а), нанометрах (1 нм-10 9 м).Цикл сетки металла находится в диапазоне от 1 до 7 А.
Расстояние между центрами соседних атомов измеряется в ангстремах (1 А = 10′, С М) Людмила Фирмаль
Половина минимального расстояния между центрами атомов называется атомным радиусом. Плотность кристаллической решетки, то есть, объем, занимаемый атомами, характеризуется координационным числом. Число атомов на равном минимальном расстоянии от данного атома называется координационным числом. Чем выше координационное число, тем выше плотность упаковки атомов. Для ячейки Куба номер корректировки указывается буквой «K»и днем» G » шестиугольной ячейки. Число атомов в элементарной ячейке называется основанием. Основание решетки обозначается буквой «I».
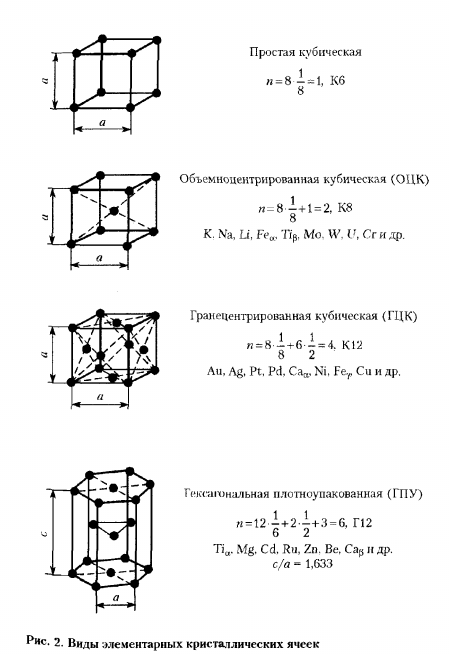
Основные типы клеток, содержащие металл (Рисунок 2) в кубических объемно-ориентированной (ОЦК), кубическая-гранецентрированная (ГЦК), и наиболее плотной гексагональной (ГПУ). 2 атома (n-2) попадают в 1 единичную ячейку ВСС.1 находится в центре куба, а атомы, которые находятся в вершине куба, составляют еще 1.Каждый атом в верхней части куба одновременно принадлежит к 8 сопряженным основным ячейкам, причем эта ячейка содержит только 1/8 части и равна (1/8) х 8-1 атому. вы можете сделать следующее: координационное число вычисляется для центрального атома и соответствует SC. 4 атома (n-4)классифицируются на 1 элементарную ячейку fcc:
1 из них вносит свой вклад в атомы вершин куба, и каждый из этих атомов принадлежит к 2 ячейкам одновременно, поэтому добавьте 3 атома в общей сложности в середине грани: (1/2) x b-3.Учитывается координационное число атомов в центре плоскости, которое соответствует К12. есть 1 единица hcp, 6 атомов на ячейку (и −6), 3 из которых находятся в ячейке.2 атома в центре Грани дают 1 атом: (1/2)x 2-1.12 атомов вершины дают 2 атома:(1/6) x 12-2.Координационное число учитывается для атомов в ячейке и соответствует г12.
Смотрите также:
| Полиморфные превращения | Классификация |
| Строение реальных металлов | Основные типы клеевых материалов |
