Оглавление:



Броматометрия
- Bro Краткое дерево Хроматографическое измерение на основе реакции BrO3- + 6H + + 6 * — = Br «+ 3H2O; 4r0, — / Br- = 1,4513 Первая избыточная капля бромата окисляет бромид-ионы с образованием свободного брома: BrO3 «+ 5Br до + 6H4» = 3Br2 + 3H20 (13,20) Поскольку реакция (13.20) не протекает с нейтральными растворами, нейтральные растворы, содержащие KBrO3 и KBr, могут храниться в течение длительных периодов времени.
- Когда такой раствор подкисляется, реакция (13.20) протекает немедленно, и свободный бром высвобождается. Это также довольно сильный окислитель (£ br, / 2Br = 1,087 В). Колориметрическое определение использует способность свободного брома реагировать с некоторыми органическими соединениями в соответствии с точной стехиометрической формулой без образования побочных продуктов.
Поэтому отмечены два основных типа колориметрического определения. Людмила Фирмаль
В первом типе реакции реакция восстанавливающего агента, определенного как бромат, используется непосредственно, а во втором типе реакции — свободный выход по схеме (13.20) во время взаимодействия бромата и бромида. Бром участвует.
В первом типе реакции образование свободного брома в качестве промежуточного продукта реакции не исключается, но в такой реакции бромид калия не вводится в реакционную систему. Рабочий раствор для хроматографии — бромат калия — обычно готовят точным взвешиванием его кристаллической соли.
Полученный KBrO3 получается очень чистым после перекристаллизации из воды и сушки при 150-180 ° С. Титр раствора бромата может быть подтвержден методом конкреций, в котором К1 добавляют к измеренному количеству бромата, а высвобожденный йод титруют тиосульфатом натрия. Водный раствор бромата калия стабилен неопределенно долго.
На практике также используется нейтральный по бромату раствор, содержащий точно известные концентрации бромата калия и приблизительно 5-кратный избыток бромида калия. При подкислении такой раствор выделяет количество свободного брома, равное количеству проглатанного бромата.
- Индикатором для колориметрического анализа является азокраситель, Как метиловый оранжевый или метиловый красный. В эквивалентной точке индикатор необратимо окисляется с образованием бесцветного продукта. Поскольку азокрасители могут быть непосредственно окислены броматом, несколько капель индикатора обычно добавляются снова до точки эквивалентности, и цвет изменяется в точке эквивалентности.
Изменяет цвет в процессе колориметрического определения l-этокситилзоидина, нафтофлавона, хинолинового желтого и т. Д. Многие неорганические и органические восстановители и окислители определяются колориметрически. Одним из важных применений колориметрического анализа является измерение сурьмы.
Титрование Sb (III) проводят при 70 ° С в растворе соляной кислоты по формуле реакции. Людмила Фирмаль
3SbCir + BrO3 + 6H + + 6CI = 3SbCU «+ Br ~ + 3H20 Титрование проводится до тех пор, пока метиловый оранжевый цвет не изменится. При нагревании с раствором соляной кислоты измеряется мышьяк (III). SNA $ Og -f BrOi + 3H20 = 3H2AsOr илиf Br ~ + 3H + Сурьма (III) и мышьяк (III) могут быть измерены в одном растворе без предварительного разделения.
Во-первых, оба восстановителя титруются вместе, сурьма (V) в этом растворе восстанавливается до Sb (III) металлической ртутью и снова титруется броматом калия. Мышьяк (V) не восстанавливается с помощью ртути и не мешает второму титрованию. Олово (II), медь (I), таллий (I), перекись водорода, гидразин и другие соединения определяются прямым взаимодействием с броматом.
Интересное бромное определение висмута на основе окисления металлической меди в растворе соляной кислоты: BiClr + 3Си + 2СГ = 3CuClf + Bi Полученный раствор меди (I) титровали броматом калия в присутствии метилового оранжевого. При изопункте индикатор разрушается, и раствор становится синим из-за не-Si.
Измерения селенита, гидроксиламина и других восстановителей выполняются запатентованным методом двойного обратного титрования: избыток бромата добавляют в аналитический раствор и затем титруют броматом. Избыток арсенита добавляется При измерении бромом окислителей (перманганата, пероксида, гипохлорита и т. Д.)
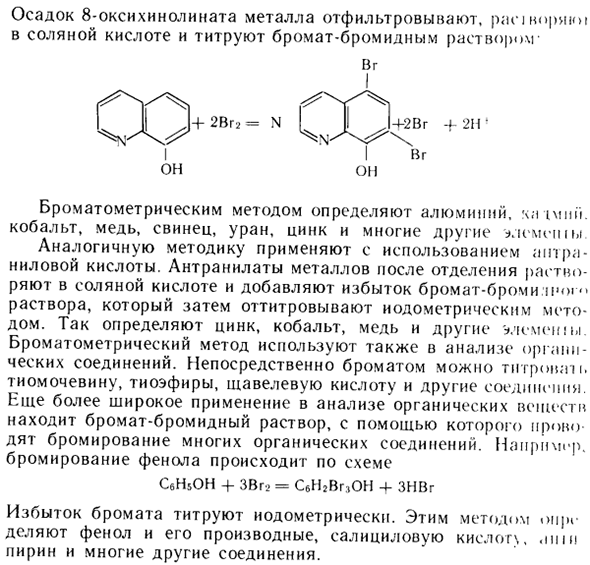
Избыток арсенита добавляется в аналитический раствор, Титруется броматом калия. Большое практическое значение имеет колориметрический метод количественного определения металлов с нанесенным 8-гидроксихинолином: Mg2 ^ + 2HOxin + 2NH3 = Mg (Oxin) 2 + 2NHr Al3 + + 3HOxin = AI (Oxin) 3 + 3H +Осадок 8-гидроксихинолината металла фильтруют, набухают соляной кислотой и титруют раствором бромид-бромида.
Vg Алюминиевая хроматография определяется хроматографическими методами. h; pmi. Аналогичные методики используются с использованием кобальта, меди, свинца, урана, цинка и многих других элементов — амтраниллориевой кислоты. После отделения антранилат металла растворяют в соляной кислоте, к раствору добавляют избыток бромата брома, а затем измельчают методом нодометрии.
Поэтому мы определяем цинк, кобальт, медь и другие edmsmmmm. Колориметрические методы также используются для анализа органических соединений. Прямое титрование бромида, диурез, тиоэфиры, щавелевая кислота и другие соединения.
Растворы бромат-бромида, в которых бромируются многие органические соединения, имеют более широкий спектр применения для анализа органических веществ. Например, бромирование фенола проводят по схеме CeHsOH + ЗВг2 = СвН2ВгзОН4-ЗНВг Избыток бромата титруется. Используя этот метод, разрешаются фенол и его производные, салициловая кислота, ми, пилин и многие другие соединения.
Смотрите также:
Решение задач по аналитической химии
| Практическое применение иодометрии | Цериметрия |
| Хроматометрия | Ванадатометрия |
