Оглавление:




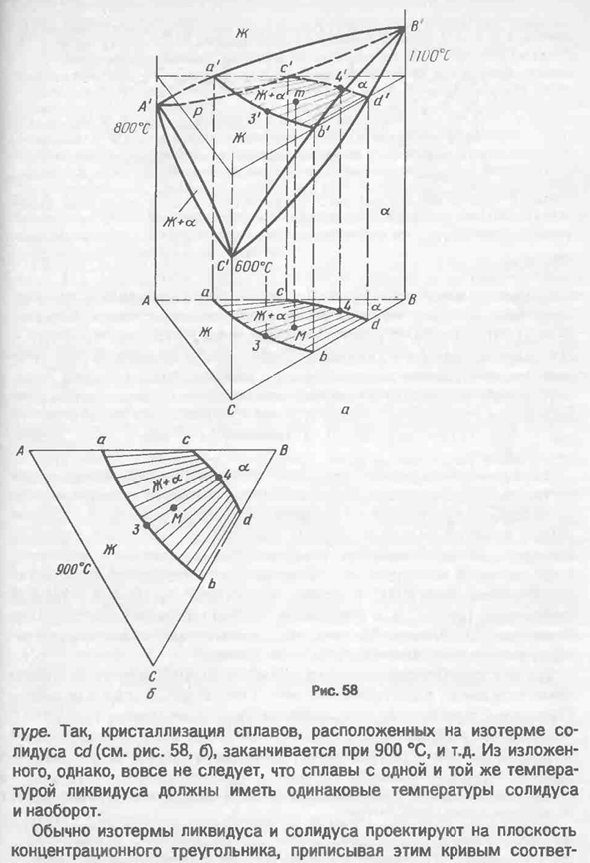


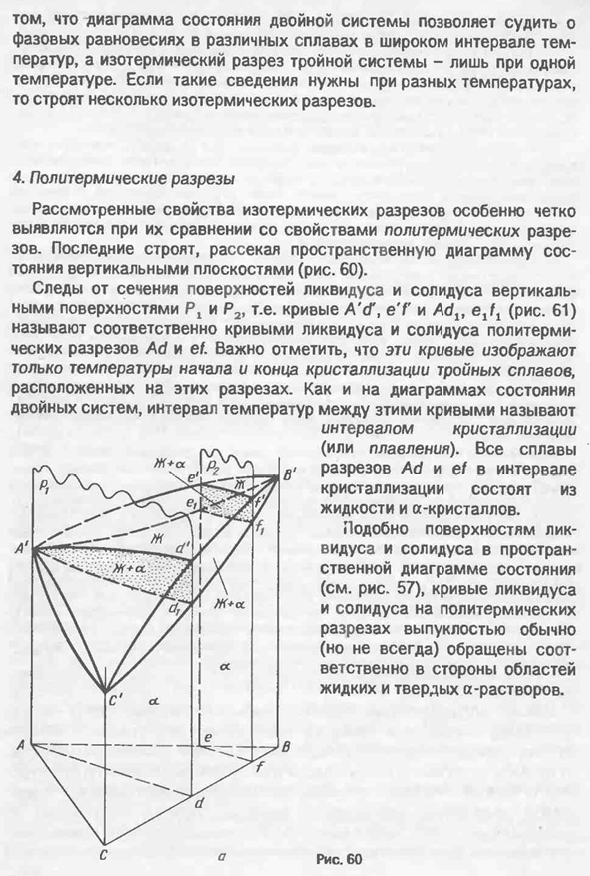


Диаграмма состояния системы с непрерывными рядами жидких и твердых растворов
- Тройная система A-B-C с двумерным равновесием W-A представляет собой систему, в которой между всеми компонентами образуются непрерывная жидкость и твердый раствор. Условия образования непрерывного твердого раствора между тремя компонентами А, В и с качественно аналогичны условиям образования таких растворов двумя компонентами (см.§ 4). если одна из модификаций полиморфного металла изоструйна по отношению к двум другим металлам (или наоборот), то непрерывная серия твердых растворов может образовывать простую и однородную структуру.
1091 двойные системы A-B, B-C и a-C диаграмма состояний без кривых ликвидуса и солидуса в крайних точках показывает пространственную диаграмму состояний системы A-B-C, b-b-c b-c 57). Бинарные линии Ликвидуса и Солидуса на этой диаграмме проходят через поверхность линий Ликвидуса и Солидуса. Над поверхностью жидкости находится объем ненасыщенной жидкости (относительно кристалла), под поверхностью твердого тела находится жидкий раствор W, — ненасыщенный объем (относительно жидкости) твердого раствора a и эти поверхности имеют те же свойства, что и кривая бинарной системы ликвидус и Солидус (см.§ 4).
Райс, пятьдесят семь. Обычно выпуклые поверхности жидкости вращаются в сторону объема жидкого раствора, а поверхности твердого тела-наоборот, в сторону объема твердого раствора, исключение из этой закономерности возможно Людмила Фирмаль
2. Кристаллизация сплава тройных а-растворов аналогична кристаллизации аналогичных двойных сплавов (см.§ 4), но отличается тем, что происходит в трехмерном пространстве диаграммы состояния(см. Рисунок). 57). В результате состав жидкостей и кристаллов изменяется вдоль пространственной кривой, которая расположена на поверхности жидкой и твердой фаз(8=K-f+ 1= 3 — 2 + 1=2).
Пусть рассматриваемая система A-B-C является наиболее сложной Однако компонент В является наиболее плавким компонентом с, компонент А имеет промежуточную температуру плавления, т. е. tnnb>(PLA> > tnnc кристаллизация сплава, точка Феро метафоры (Точка 1*) является началом (и другим фазовым превращением) кристаллизации на поверхности жидкости, некоторые сплавы переохлаждения требуются, но этим пренебрегают (см. Главу 2, 4). Состав первого кристалла, выделившегося из жидкости W x, определяется точкой 2′, расположенной на поверхности твердого тела. В терминах концентрационного треугольника состав жидкого кристалла и Кристалла в начальный момент кристаллизации представлен точками м и 2 соответственно.
- Положение первого коноде1 2’(или м2) таково, что оно направлено на наиболее тугоплавкий компонент, в данном случае B. In другими словами, первый кристалл сплава м, начальная стадия кристаллизации его сплава М, может быть записан W t — *A2 (Ilii^ — *A2). Если температура падает ниже состава а-кристалла, то она не остается постоянной, а изменяется вдоль кривой 2’4’6′, которая расположена на поверхности твердого тела. Вдоль кривой G3 ’5′, расположенной на поверхности жидкости, изменяется состав кристаллизующейся жидкости. С точки зрения треугольника концентрации, это кривые M35 и 24M. Конода3’4′ обязательно проходит через метафорическую точку Т сплава (на плоскости концентрационного треугольника-через точку м). О степени кристаллизации (целостности) сплава м при температуре Т2 можно судить по правилу рычага.
В этом примере пропорции жидких кристаллов W’E-и a’4 приблизительно равны(T4 73 ’4′ =m3 73’4′ или M4 / 34==M3 / 34). Таким образом, к рассматриваемому моменту сплав м кристаллизуется примерно наполовину. Кристаллизация сплава м заканчивается при температуре t3, и все кристаллы принимают состав исходного сплава, когда состав Кривой 2’4’6’изменяется в направлении от точки 2 ’к точке 6′. В этот момент в сплаве, согласно регулировке рычага, исчезает последний след жидкости y-W, где завершающей стадией кристаллизации сплава M может быть G. Запишите его как W ’5 — * a’6 (или W5- * am). Кроме того, фазовое превращение не происходит при охлаждении сплава м до комнатной температуры. — 3 Весь процесс кристаллизации сплава M записывается как W V_ 5, ——- int l — » 3″ Т I-с ——- «2’-6’(или-5 ——- «2 — м) — в
Кривой охлаждения этот сплав имеет две важные точки (перегибы), которые соответствуют температуре начала и конца его кристаллизации. Людмила Фирмаль
Как свидетельствуют их проекции М35 и 24М на плоскость треугольника, сосредоточенного на плоскости солидуса с кривыми 1’3’5′ и 2 ’4’6′ ликвида, при кристаллизации сплава м Коно-да, расположенного либо в вертикальной плоскости, соединяющей конкретные точки жидкости и А-кристаллов, и сохраняющего отношение к горизонтали, то под конода » конец скольжения?»на поверхности ликвидуса опишите кривую 1’3 ′ 5′, а на поверхности солидуса опишите вторую кривую 2’4 ′ 6′. Направление вращения Коннода вокруг репрезентативной прямой сплава м совпадает с направлением снижения температуры на поверхности жидкой фазы и поверхности твердой фазы, причем последняя является плавящей составляющей А,
В и с (плавление Кристалла). Как и сплав М, другие сплавы этой системы кристаллизуются. 3. Если изотермическое сечение пространственной диаграммы рассекается несколькими горизонтальными плоскостями, параллельными плоскости концентрационного треугольника, то получается изотермическое (или горизонтальное) сечение. В рассматриваемой системе предполагается, что компоненты А, В и с плавятся при 800, 1100 и 600 ° С соответственно(рис. 58, а).
Затем, как показано на рисунке, можно построить изотермическое поперечное сечение 900 ° C. 58, б. следы от поперечных сечений жидкой и твердой поверхностей (кривые a’b ’и C’d’ на пространственной диаграмме и ab и cd на плоскости концентрационного треугольника) называются изотермой жидкой и твердой поверхностей и ясно, что кривизна этих Изотерм определяется кривизной линий жидкой фазы и поверхности твердой поверхности. Обычно жидкая изотерма выпукла в сторону области жидкого раствора (как изотерма ab), а твердая изотерма выпукла в сторону области A-Rast (как изотерма cd) наоборот. Все сплавы, находящиеся в одном жидком изотопе, начинают кристаллизоваться при одинаковой температуре. Например, кристаллизация сплава, расположенного на изотерме ликвидуса ab (рис. 58, б) начинается при температуре 900 ° С, то есть изотермы.
Аналогично, все сплавы, расположенные в одной и той же изотерме солидуса, завершат кристаллизацию при одной и той же температуре- 112-1 пятьдесят восемь Поэтому кристаллизация сплава происходит на твердой изотерме cd (см. фиг. Концы на 58, b), 900°C, etc. Однако из вышеизложенного следует, что сплав, имеющий одинаковую температуру жидкой фазы, должен иметь одинаковую температуру твердой фазы, а не наоборот. Обычно изотермы ликвидуса и солидуса проецируются на плоскость концентрационного треугольника и соответствуют этим кривым- 113S600*Ы Но С 600-х годов б Рис пятьдесят девять
Соответствующая температура. В зависимости от количества изотермических участков(или»ступеней» температуры), количество Изотерм может варьироваться. Чтобы избежать путаницы, изотерма жидкости и твердого тела рисуется отдельно. 59). Имея такой прогноз поверхности Ликвидуса и солидуса, можно определить температуру начала и конца кристаллизации любого тройного сплава. Например, сплав М начинает кристаллизоваться при −935°с(Рис. 59, А), и финиш-при-830°C(см. диаграмму. 59, Б)и др. Жидкая и твердая изотермические фазы, состоящие из одинаковой температуры, представляют собой равновесный состав жидкости и А-кристалла в сплаве двухфазного w+A. 58, Б) на жидкой фазной изотерме ab показана точка, представляющая состав жидкости, на твердой фазной изотерме cd показана вторая точка, представляющая состав а-кристаллов.
Например, в сплаве 900 ° С М состав жидкости представлен точкой 3, а кристалла-точкой 4(см. Также рисунок). 57). Соединяя эти точки Конода34 обязательно проходит через фигуративные точки этого сплава. Как и на диаграмме пространственного состояния, коноде34 может быть взят как рычаг, а метафорическая точка сплава M может быть взята как ее точка опоры. В свою очередь, доля жидких кристаллов W3 и A4 в этом сплаве составляет 900. °C определяется соотношением сегментов M4 / 34 и M3 / 34. Аналогичные коноды соединяют переносные точки равновесной фазы в других сплавах в двухфазной области W+A. При построении конодов в двухфазных областях W+неизбежно возникает вопрос об их относительном расположении. Прежде всего, следует отметить, что конноды для тройных сплавов типа М должны занимать промежуточное положение между»первым»
Коннодом АС двойной системы А-В и «последним» Коннодом БД системы В-С. 114j+a коноды не пересекаются друг с другом. Каждая точка на Ликвидус-изотерме ab соответствует четко определенной точке на Солидус-линейной изотерме cd (см. рис. 58, б). Показано, что касательные этих кривых не совпадают с коннодами в двухфазной области W + a. это означает, что изотермы ликвидуса ab и солидуса cd не могут касаться боковых стенок концентрирующего треугольника AB и BC соответственно, а также C, B и d в точке a. Если Коноды превышают изотерму твердого cd и продолжаются по направлению к огнеупорному компоненту 8, то их продолжение не должно проходить через вершины сосредоточенного треугольника. Д. А. Петров показал, что если Канадия совпадает с отрезком, проходящим через точку метафоры двухфазного сплава и компонентов воздушной среды, то известны правила Р Коноды двухфазной области W+A представляют собой линии изоактенности каждого компонента,
полученные из геометрической термодинамики. Другими словами, коноды соединяются с точками изотермы ликвидуса и солидуса, имеющими одинаковое значение термодинамической активности каждого компонента в соседних однофазных областях W и O. M. согласно секущему правилу Хиллерта, линия, проведенная через любую вершину концентрационного треугольника (например, вершину компонента B), не проходит через коноды концентрационного треугольника, т. е. коноды в направлении более непокорного компонента B, т. е. изотропной линии этого компонента в однофазной области A -, двухфазной области W+a (см. выше). G. M. It показано, что расширение Конода из двухфазных CD-Изотерм для неплавящегося компонента B пересекает AB или BC сторону концентрационного треугольника в зависимости от отношения коэффициентов разбиения компонента A к C, как показано Кузнецовым.
Если коэффициент распределения компонента больше похож на коэффициент распределения компонента, то конод для изотермы солидуса пересекается со стороной AB (сечение SV) и, наоборот, коэффициент распределения компонента A. Закономерность конфигурации конодов в двухфазной области W+A является качественной. Точную структуру коноды в этой области можно сказать только в том случае, если известен состав равновесной фазы в двухфазном сплаве. Когда жидкие и твердые изотермы построены экспериментально (или теоретически рассчитаны), составы этих фаз могут быть определены экспериментально или рассчитаны. Поэтому полностью составленное изотермическое сечение (изотермы + коноды жидкости и двухфазные W + A) позволяет определить не только состав равновесной фазы в тройном сплаве при заданной температуре, но и ее долю.
Информация о тройном сплаве, полученная с помощью изотермического разреза, аналогична информации о двойном сплаве, полученной из диаграммы двойной системы. Разница между изотермическим сечением и бинарной фазовой диаграммой、 Диаграмма состояния двойной системы позволяет судить о фазовых равновесиях в различных сплавах в широком диапазоне температур, а изотермические сечения тройных систем строят несколько изотермических сечений, если такая информация при одной температуре необходима при разных температурах. 4. Рассмотренные характеристики изотермического поперечного сечения становятся особенно очевидными при их сравнении с характеристиками мультитермического поперечного сечения.
Последний строится путем рассечения пространственной диаграммы состояния в вертикальной плоскости(рис. 60). Следы поперечного сечения поверхности ликвидуса и солидуса по вертикальной плоскости и P2, т. е. кривые A’, e’f и Adx (рис. 61) называется кривыми жидкой фазы и кривыми твердой фазы секций перегрева Ad и ef соответственно. Важно отметить, что эти кривые показывают только температуру начала и конца кристаллизации тройного сплава, расположенного в этих сечениях. Как показано на диаграмме состояния двойной системы, температурный интервал между этими кривыми называется интервалом кристаллизации (или плавления). Все сплавы сечений Ad и ef интервала кристаллизации состоят из жидкости и кристаллов А. Один.
И Но Как жидкая фаза, так и твердофазная поверхность в пространственной фазовой диаграмме(см. фиг. 57), линии Ликвидуса и твердой фазы многогранника выпуклой частью обычно обращены соответственно к области жидкого и твердого а-раствора (но не обязательно). Райс, шестьдесят. 116). Шестьдесят один. Полиповерхностные сечения ad и EF внешне похожи на фазовые диаграммы двойных систем A-B, B-C или a-C. Однако это сходство носит только внешний характер.
Политермический разрез принципиально отличается от диаграммы состояния бинарной системы. В общем случае кривые жидкой фазы и твердой фазы секций полигрева не отражают состав равновесной фазы в интервале кристаллизации. Политермическая секция отслеживает изменения состава жидкости и кристаллов в заданных интервалах кристаллизации тройных сплавов, а политермическая секция этих фаз как точка, представляющая состав фаз, позволяет судить только о критической точке тройных сплавов, то есть о температуре в начале и конце различных фаз превращения.
Смотрите также:
Методические указания по материаловедению
