Оглавление:
Электрохимическая коррозия
Электрохимическая коррозия — наиболее распространенный вид коррозии металлов. Протекает на поверхности металлических конструкций, деталей машин, трубопроводов во влажной атмосфере, в грунтовой и морской воде, в растворах электролитов.
По механизму действия электрохимическая коррозия представляет собой гетерогенный окислительно-восстановительный процесс, протекающий на поверхности металла в присутствии электролита. В отличие от химической коррозии при электрохимической коррозии на поверхности металла протекают электрохимические процесса, в которых процессы окисления и восстановления пространственно разделены. Причиной возникновения электрохимической коррозии является электрохимическая неоднородность поверхности металлов, которая является следствием химической и фазовой неоднородности поверхности, структурной неоднородности защитных плёнок, неравномерности распределения деформаций в металле и др. В результате этого на поверхности металла образуется большое количество активных (анодных) и пассивных (катодных) участков. В растворе электролита между этими участками возникают короткозамкнутые гальванические элементы. Таким образом, процессы электрохимической коррозии можно рассматривать как результат работы на поверхности металла огромного количества короткозамкнутых микрогальванопар.
Термодинамическая возможность, протекания электрохимической коррозии
Самопроизвольное протекание химической реакции возможно только в том случае, если изменение энергии Гиббса отрицательно  Изменение энергии Гиббса при работе гальванического элемента может быть рассчитано по уравнению
Изменение энергии Гиббса при работе гальванического элемента может быть рассчитано по уравнению
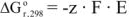
где z — заряд иона металла;
Е — ЭДС образовавшегося гальванического элемента;
F — число Фарадея, F = 96500 кл/моль.
Как следует из уравнения (14), изменение энергии Гиббса отрицательно только в том случае, если ЭДС гальванического элемента положительно, Е > 0.
ЭДС гальванического элемента рассчитывается как
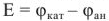
В образовавшемся при коррозии короткозамкнутом гальваническом элементе электродный потенциал катода — 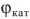 равен равновесному окислительно-восстановительному потенциалу окислителя
равен равновесному окислительно-восстановительному потенциалу окислителя  электродный потенциал анода —
электродный потенциал анода — 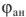
равен равновесному электродному потенциалу металла — 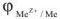
Тог 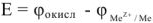
Положительное значение ЭДС в соответствии с уравнением (14) может иметь место только при условии, что
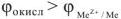
Следовательно, работа возникающих короткозамкнутых гальванических элементов на поверхности металла, т.е. самопроизвольное протекание коррозионных процессов, возможна только в том случае, если равновесный окислительно-восстановительный потенциал окислителя больше, чем равновесный электродный потенциал металла. Чем больше разность электродных потенциалов окислителе и металла, тем сильнее протекает коррозия.
Процессы, протекающие при электрохимической коррозии
Анодные процессы. На анодных участках поверхности при коррозия происходит процесс окисления металла и переход продуктов окисления в раствор или образование поверхностнах соединений на металле
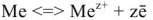
Электродный потенциал анодных участков можно принять равным электродному потенциалу металла
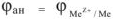
Катодные процессы. За счет перетекания свободных электронов с анодных участков к катодным происходит их поляризация. При воостановлении на катодных участках различных окислителей из раствора происходит деполяризация этих участков. Деполяризация катодных участков может осуществляться по различным схемам:
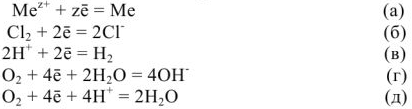
В реальных условиях на катодных участках протекают те процессы, окислительно-восстановительный потенциал которых более положителен. Наиболее часто наблюдается восстановление ионов водорода — коррозия с водородной деполяризацией (уравнение в) и восстановление кислорода -коррозия с кислородной деполяризацией (уравнение г,д).
Коррозия металлов с водородной деполяризацией
Процессы «коррозии металлов, у которых катодная деполяризация осуществляется водородными ионами по реакции
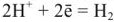
называются коррозией металлов с водородной деполяризацией.
Согласно уравнению (17) самопроизвольное протекание коррозии с водородной деполяризацией возможно только при условии
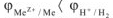
Величина электродного потенциала водорода зависит от кислотности и парциального давления водорода и может быть рассчитана по уравнению
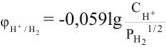
где 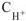 — молярная концентрация ионов водорода в растворе, моль/л;
— молярная концентрация ионов водорода в растворе, моль/л;
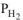 — парциальное давление водорода в атмосфере,
— парциальное давление водорода в атмосфере, 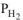 = 5,1 10-2 Па (510’7 атм.)
= 5,1 10-2 Па (510’7 атм.)
В щелочной среде 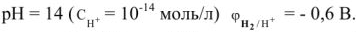 .
.
В нейтральной среде при 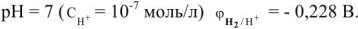
В кислой среде при 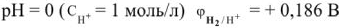 .
.
Следовательно, с увеличением концентрации ионов водорода коррозионная активность среды возрастает. Коррозия металлов с водородной деполяризации происходит в растворах кислот, а для активных металлов с низким значением электродного потенциала и в воде.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
