Электролиз водных растворов
В водных растворах процесс элекролиза осложняется наличием ионов 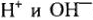 . В процессе электровосстановления на катоде создается конкуренция за преимущественное связывание электронов между ионами водорода и ионами металла. При этом чем отрицательней потенциал электрода, тем слабее окислительная способность его ионов, т.е. способность присоединять электроны, тем труднее идёт их восстановление.
. В процессе электровосстановления на катоде создается конкуренция за преимущественное связывание электронов между ионами водорода и ионами металла. При этом чем отрицательней потенциал электрода, тем слабее окислительная способность его ионов, т.е. способность присоединять электроны, тем труднее идёт их восстановление.
Порядок катодных реакций восстановления
Различают металлы (Me):
1) с наиболее отрицательными значениями нормальных электродных потенциалов (щелочные и щелочно-земельные и алюминий).
При электролизе водных растворов солей указанных металлов на катоде восстанавливаются не их катионы, а ионы водорода воды (выход по току равен нулю). ,
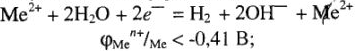
При электролизе водных растворов солей металлов данной группы на катоде одновременно разряжаются катионы металла и водорода:
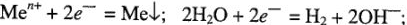
3) с наибольшими положительными значениями нормальных электродных потенциалов. Эти металлы расположены в ряду напряжения после водорода. При электролизе водных растворов солей этих металлов восстанавливаются только их ионы (выход по току « 100 %).
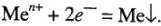
Вероятность восстановления на катоде ионов металла и ионов водорода зависит от концентрации электролитов. При высокой концентрации электролита потенциал сдвигается в положительную сторону. Уменьшая концентрацию ионов водорода, сдвигают потенциал в электроотрицательную сторону и таким образом увеличивают вероятность восстановления на катоде ионов металла, а не водорода.
Итак, на практике следует учитывать условия электролиза:
1) концентрацию катионов;
2) pH раствора (от него зависит окислительная способность ионов водорода  :
:
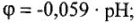
3) материал катода (процесс катодного выделения водорода) при потенциале  = -0,41 В может идти только на платинированной пластине, на графитовом катоде процесс идет при потенциале
= -0,41 В может идти только на платинированной пластине, на графитовом катоде процесс идет при потенциале  = -1,064 В:
= -1,064 В:
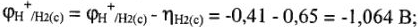
4) плотность тока.
Порядок анодных реакций окисления
Среди анионов на аноде также происходит своеобразное соперничество между анионами солей кислот и анионами 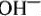 .
.
Здесь наблюдается такая закономерность:
1) при электролизе водных растворов солей бескислородных кислот или самих кислот — анионов  ,
,  , — на аноде будут разряжаться эти анионы;
, — на аноде будут разряжаться эти анионы;
2) йри электролизе кислородсодержащих кислот и их солей (анионы 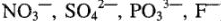 ) на аноде разряжаются гидроксильные ионы
) на аноде разряжаются гидроксильные ионы 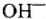 .
.
Такие процессы протекают на нерастворимых анодах (например: 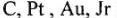 ).
).
При электролизе с растворимыми анодами будет происходить растворение металла и переход его в раствор в виде ионов.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
