Оглавление:








Фазовые переходы первого и второго рода.
- Фазовый переход Первый и второй виды. Критические явления Мы приняли во внимание равные условия. При наличии » равновесия гетерогенных систем(8.9)» Как долго можно поддерживать равновесие в сложной системе Если что-то нарушает хотя бы 1 Условие долго
Равновесие начинает переход материи в систему. Газ, от одного кристаллического преобразования к другому кристаллическому преобразованию Теоретические и экспериментальные исследования Фазовое преобразование позволило разделить их на 2 части Класс:
Например, от одного этапа к другому Твердое в жидкое, жидкое в газ Людмила Фирмаль
фазовый переход и фазовый переход класса 1 Второй вид движения Фазовый переход первого рода. Уравнение Клапейрона Клаузиуса Фазовый переход первого рода Сопутствующая фаза метаморфозы понимания Поглощения или выделения скрытой теплоты Резкое изменение определенного объема. Фазовый переход является обратимым
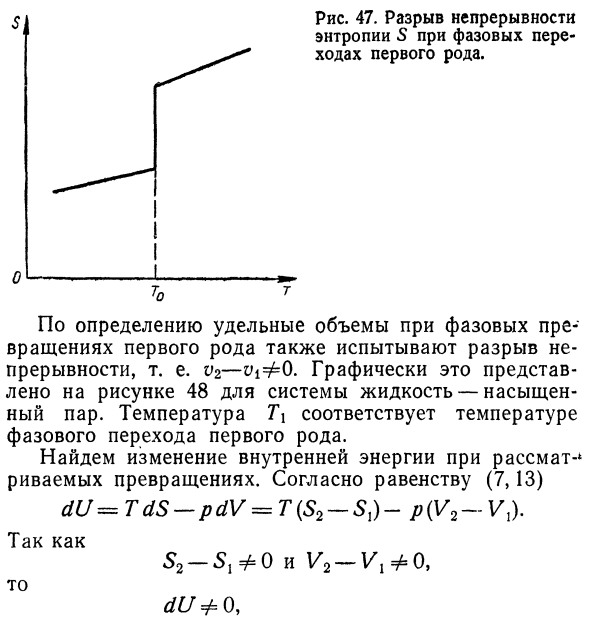
Примените второй закон процесса, термодинамику: L и D’q Интеграл (B, 12) равенства при T = const будет иметь вид: Где% — скрытая теплота превращения при фазовом переходе Миграция. Согласно определению первого фазового перехода Своего рода HFO. 53-Si = 0 0, то есть во время фазового перехода Первый вид, энтропия постоянно разрушается Непрерывность (рис. 47).
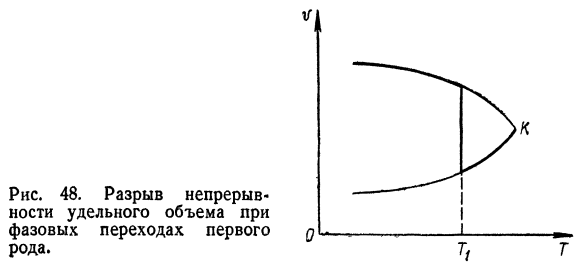
- Двести семь Рисунок 47.Разрыв непрерывности Энтропии на этапе 5 Первый вид перехода. По определению, конкретный объем перед фазой равен、 Существует также пробел в первичной трансформации. Непрерывность, то есть V2-v ^ O графически, она представляет Рисунок 48 насыщенной жидкостью Насыщенный пар. Температура t \соответствует температуре Фазовый переход первого рода. Изменение внутренней энергии
Преобразование. Согласно равенству G, 13) дю ТДС-ПДВ = Т (С2-сл) — п(У2 — У2). С И затем… 53-5.、 дл / фо、 И U2- Итак, внутренняя энергия в данном случае равна 11) изменение, согласно G Свободная энергия DT_0 для изотермических процессов、 И затем… Аналогично, изменение энтальпии при p = const: диджей= : Наконец, изменение термодинамического потенциала
Он также изменяется в конвульсивной манере. Людмила Фирмаль
При рассматриваемых условиях (T = const, jt?= константа) Равный: dpSdTtVd ^ о; ФГ-Ф2. (9.1) как вы можете видеть, в отличие от всех известных термодинамики、 Термодинамическая функция, только термодинамический потенциал Гиббс не имеет фазового разрыва Первый вид transition. It это очень удобно. При изучении фазовых метаморфоз. Частичная производная этой функции 2 фазы, температуры и давления в гетерогенных системах
Затем вычтите их из других G, 23. 7.24): = 52-5tOO, (9.2) Полученное соотношение зависит от его специфики Производная термодинамического потенциала в Фазовый переход первого порядка внезапно изменяется Различный. Фазовый переход первого порядка включает в себя Преобразование однокомпонентных систем (испарение、 Сублимация, переход из твердого состояния в жидкое), переход от Как еще одно изменение. Весь этот процесс Связанные с выделением или поглощением тепла、
Изменения в определенном объеме. Основные уравнения, характеризующие фазу Первый вид перехода-уравнение клапейро Клапейрон-Клаузиус, вы можете легко получить от условий 2 равенства химических потенциалов при равновесии Этапы: Я ’(Р, Т)= Я «(/>, Т).(9.3) Используя уравнение (9.3) Дифференциальное уравнение кривой равновесия. Рисунок 48.Разрыв непрерывного Непрерывность определенного объема Фазовый переход первого d Нравится. Р 20 футов.
Действительно, дифференциация равенства(9.3)、 Выяснить: < /Я ’( / >, т)= д \ х «(р% т), или Откуда (д \ Я „\%л (д \ Я \ \ Д / \ т др) Т c / Φ= 0, так что если считать©\ k = — SdT + Vdp、 Мы получаем: Уравнение (9.4) является дифференциальным уравнением Уравнение равновесной кривой, соединяющей тепло Переход[A,= r (S „—S’) или позже], переход для определенного объема И наклон кривой равновесия при переходе point. To письмо* Чаще всего это происходит в следующем виде: ДП _ х ДТ ~~ т(в “ — в) (Например, см. Главу 4,§ 4).
Если на систему не влияет давление I, но Когда мы получим обобщенную силу Y、 Обобщенные уравнения вида (9.4): Ды _ как Где x “ — x / = Dl-скачок внешнего параметра и является сопряженным Обобщенная сила пары В уравнении Клапейрона-Клаузиуса Для всех фазовых равновесий i> 0 разность равна
Определенный объем, v2-vi, может быть положительным Позитив и negative. In первый случай,-а — > о、 То есть, когда давление увеличивается, точка плавления (Испарение, сублимация) увеличивается. 2-й случай — gjr <0, то есть при повышении давления температура плавления* Лень лаз (испарение*сублимация) уменьшается. 210 для большинства объектов, таких как, например, при плавлении, v » > v \
Итак, в таком теле есть-jy-> 0. Однако в воде, висмуте, чугуне、 Для них^ — <0, так как плавление твердой фазы уменьшается、 То есть снижение температуры плавления при увеличении давления Толпа. Теплоемкость при постоянном давлении в фазе кф Фазовый переход первого порядка, равный Бесконечности. Конечно. Брак _(йд \ — ВСТ).Девять Но d’Q =?О, и гамма= 0, и, следовательно, СР = ОО、 Используя равенство (9.3), вы можете легко отобразить фазовые переходы rm и Type 1 равны Бесконечность.
Смотрите также:
Решение задач по термодинамике
