Химическая коррозия
Химическая коррозия протекает на поверхности конструкций и, деталей, работающих при высоких температурах на воздухе или в другой газовой среде — в нагревательных печах, двигателях внутреннего сгорания, газовых турбинах и т.п., а также в трубопроводах для перекачки нефти и нефтепродуктов и емкостях для их хранения.
По механизму действия химическая коррозия представляет собой гетерогенный окислительно-восстановительный процесс взаимодействия металла и какого-либо окислителя. Принципиальная возможность протекания таких реакций с точки зрения, термодинамики оценивается величиной энергии Гиббса — 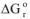 . Как указывалось выше, для большинства металлов энергия Гиббса реакции окисления кислородом уже при обычной температуре меньше нуля и в соответствии с уравнением
. Как указывалось выше, для большинства металлов энергия Гиббса реакции окисления кислородом уже при обычной температуре меньше нуля и в соответствии с уравнением 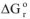 =-RTInK константа равновесия К > 1. Следовательно, даже при обычной температуре npowtcc окисления этих металлов принципиально возможен. При повышении температуры величина энергии Гиббса больше уменьшается, возможность протекция химической коррозии существенно увеличивается.
=-RTInK константа равновесия К > 1. Следовательно, даже при обычной температуре npowtcc окисления этих металлов принципиально возможен. При повышении температуры величина энергии Гиббса больше уменьшается, возможность протекция химической коррозии существенно увеличивается.
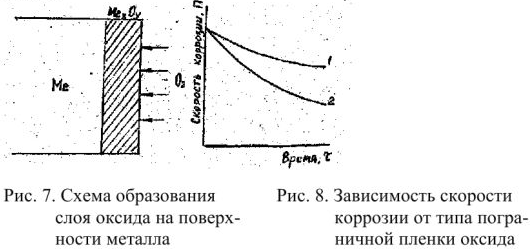
Рассмотрим механизм химической коррозии на примерз газовой коррозии (рис. 7). Взаимодействие металла о кислородом происходит по схеме: 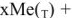
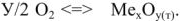 . При окислении поверхностного слоя металла образуется трехмерный слой оксида, который препятствует доступу кислорода к поверхности металла. Скорость дальнейшего окисления металла будет зависеть не столько от скорости реакции окисления металла кислородом, сколько от скорости диффузии кислорода через пленку оксида. Поэтому, защитное действие пленки будет тем сильнее, чем выше ее сплошность и ниже диффузионная способность.
. При окислении поверхностного слоя металла образуется трехмерный слой оксида, который препятствует доступу кислорода к поверхности металла. Скорость дальнейшего окисления металла будет зависеть не столько от скорости реакции окисления металла кислородом, сколько от скорости диффузии кислорода через пленку оксида. Поэтому, защитное действие пленки будет тем сильнее, чем выше ее сплошность и ниже диффузионная способность.
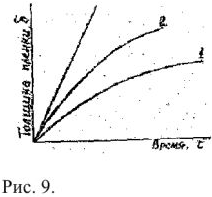
Если образующаяся оксидная пленка трещиноватая, рыхлая, слабо связана с поверхностью, то скорость коррозии с течением времени практически не замедляется (рис,8, кривая I), что характерно для железа, магния и ряде других металлов. Если образующаяся оксидная пленка сплошная, плотная, прочно связана о поверхностью, то скорость коррозии с течением времени резко уменьшается и коррозия может практически прекратиться (рис. 8, кривая 2), что характерно для алюминия, ниобия и ряда других металлов.
Устойчивость металлов против химической коррозии можно в первом приближении оценить по величине фактора Пиллинга-Бедвордса — а, характеризующего сплошность пленки.
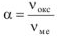
где 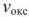 — молярный объем оксида металла, см3/моль;
— молярный объем оксида металла, см3/моль;
 — молярный объем металла, см3/моль.
— молярный объем металла, см3/моль.
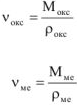
где 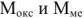 — молярные массы оксида металла и металла соответственно;
— молярные массы оксида металла и металла соответственно;
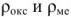 — плотности оксида металла и металла соответственно.
— плотности оксида металла и металла соответственно.
Если а = 1,2 — 1,6, на поверхности металла образуются сплошные и устойчивые оксидные слои. Поэтому алюминий (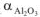 = 1,31), олово (
= 1,31), олово (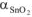 = 1,33), ниобий (
= 1,33), ниобий (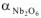 = 1,57) и ряд других металлов являются устойчивыми против химической коррозии.
= 1,57) и ряд других металлов являются устойчивыми против химической коррозии.
Если a < 1,0, то поверхностный слой оксида металла является пористым и трещиноватым. Через трещины и поры в пленках оксида кислород свободно проникает к поверхности металла и процесс окисления продолжается с высокой скоростью. Поэтому, например, магний (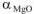 = 0,79) малоустойчив против химической коррозии.
= 0,79) малоустойчив против химической коррозии.
Если a > 1,6, то оксидные пленки за счет больших внутренних напряжений отслаиваются, нарушая сплошность покрытия. Поэтому металлы О; большой величиной а (например, железо 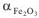 = 2,0) также малоустойчивы против химической коррозии.
= 2,0) также малоустойчивы против химической коррозии.
Скорость окисления металла определяется скоростью роста оксидных пленок, которая лимитируется Скоростью диффузии ионов кислорода 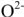 через оксидный слой к поверхности раздела металл — оксид или диффузией ионов металла
через оксидный слой к поверхности раздела металл — оксид или диффузией ионов металла 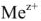 через оксидный слой к внешней его поверхности.
через оксидный слой к внешней его поверхности.
Если диффузионная способность ионов через оксидный слой мала, то рост пленки осуществляется по логарифмическому закону (рис.9, кривая I) 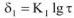
где 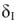 — толщина оксидного слоя; т — время.
— толщина оксидного слоя; т — время.
В этом случае рост пленки быстро прекращается. Пленка хорошо защищает металл от коррозии. Такие металлы являются коррозионностойкими.
Если диффузионная способность ионов относительно невелика, то с ростом толщины слоя происходит затухание диффузии и рост пленки подчиняется параболическому закону (рис.9, кривая 2) 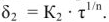
Скорость роста пленки замедляется со временем. Такие пленки удовлетворительна защищают металл от коррозии и сами металлы обладают удовлетворительной коррозионной стойкостью. Если диффузионная способность ионов черев оксидный слой велика, то увеличении его толщины практически не замедляет процессы диффузии и рост пленки подчиняется линейному закону (рис.9, кривая 3).
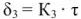
В этом случае скорость роста пленки не зависит от ее толщины, и оксидная планка не защищает металл от коррозии. Такие металлы являютоя коррозионно нестойкими. Скорость химической коррозия резко увеличивается с повышением температуры, так как существенно возрастает скорость диффузии ионов окислителя или ионов металла через пограничный оксидный слой. Вследствие этого с повышением температуры изменяется и закон роста пограничных пленок — от логарифмического к линейному. Поэтому металлы которые при обычных температурных являются устойчивыми против коррозии, при высоких температурах могут терять свою коррозионную стойкость.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Классификация коррозионных процессов в химии |
| Скорость коррозии и ее характеристика в химии |
| Электрохимическая коррозия в химии |
| Коррозия металлов с кислородной деполяризацией в химии |
