Оглавление:








Химические реакции в системе с компонентов
- Химические реакции в системах, содержащих компоненты Ознакомившись с общими характеристиками экстенсивных и интенсивных переменных, можно перейти к более детальному рассмотрению переменных, что позволит определить состав системы, в которой может протекать физико-химический процесс. Из 1(1.34) также видно, что максимальное значение одной кривой соответствует минимальному значению другой кривой.
Очевидно, что в обычном смысле слова крайняя точка в обычном смысле слова видна в водно-этанольной системе кривой Х2-0,10 компонента парциального молярного объема, а точка разрыва V обусловлена перестройкой структуры воды под воздействием молекул спирта. А. Михайлов, Ж. СХ 2, 677(1961)). (Отредактированный)) 2 в идеальной системе vt и v2 композиционно независимы и равны соответствующему молярному объему. (Отредактированный))
- Во-первых, мы указываем определение замкнутой системы. Если в ходе рассматриваемого процесса не происходит переноса веществ в систему или из нее, то рассматривается система closed. In другими словами, масса различных компонентов каждой фазы системы изменяется только в результате физико-химических процессов в самой системе.
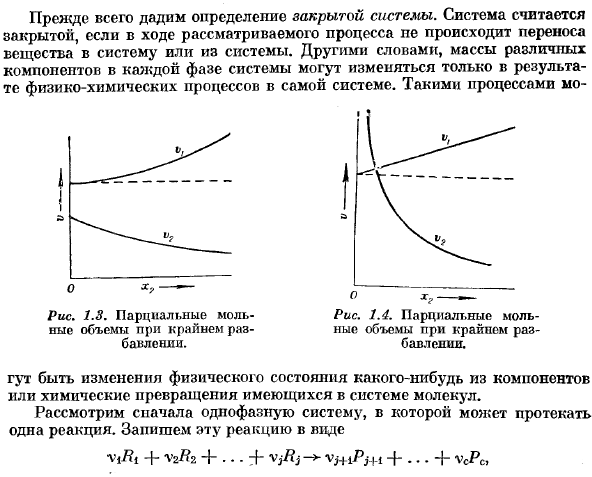
Такой процесс может Рисунок 1.3.Частичный молярный объем в крайнем разведении. О О Рисунок 1.4.Чрезвычайно разбавленный частичный молярный объем. Это могут быть изменения в физическом состоянии компонентов или химические изменения в молекулах, присутствующих в системе. Во-первых, мы рассмотрим однофазную систему, в которой может происходить реакция odpa. И я собираюсь написать эту реакцию в форме Cl ТЛ + П2#2 +••-+ VjRj ВХ имп + Я-Ф. 。 。 — }- ПДС < Здесь Rj-вещество, вступающее в реакцию, Pj + i, -..ПК есть Продукт реакции.
Коэффициент ви…»vc называется молярным коэффициентом или стехиометрическим коэффициентом компонентов 1, 2, P. In в дальнейшем стехиометрический коэффициент компонентов, образующихся при реакции слева направо, считается положительным, а коэффициент расходящегося комипепта-отрицательным. Таким образом, вы можете написать (137> ГШ-М1 = Вими |; чч-ЛЦ = vimig; МС-МС = vcMcl、
Из закона определенного соотношения следует, что увеличение массы компонента i образуется в ходе реакции за счет молекулярной массы M% илопропионопальпера и стехиометрического коэффициента в непосредственной реакции. Людмила Фирмаль
Здесь£называется степенью полноты реакции 1 или просто координатами реакции. по М°i, Если степень полноты реакции равна нулю, то начальная масса компонента обозначается нулевой точкой. Таким образом, начальное состояние определяется соотношением ξ = 0. = 1 соответствует преобразованию vi. * «vj грамм молекулы 7?I,…In, Hj 1 Этот параметр был введен до появления Donde и систематически использовался в следующей работе. [5] равный 117 страницам, (318). (Ссылки приведены в конце книги). Vj + i «• • * » vc грамм-молекулы Pj + i,…Скажем, если Pc-система перешла из состояния J = 0 в состояние£= 1, то 1 эквивалент реакции прошел.
Напомним, что согласно принципу сохранения массы, общая масса системы не изменяется, добавляя уравнение (1.37).、 (1.38) О = ’ 2 Это соотношение называется стехиометрическим уравнением рассматриваемой реакции. Из (1.37), в замкнутой системе, где происходит только 1 реакция, переменные r, ii,…непеременные, mc, ξ и mn,…, может быть заменен на mc. Поэтому, учитывая/? R?…в случае tos, термодинамическое состояние системы определяется 2 физическими переменными (например, T и p) и 1 химической переменной.
Выражение (1.37) можно различить по времени. Напомним, что начальная масса неустойчива、 (1.39) Ди? Н {XiMi (1.40) дм2 ДМС ^ ДМИ ДТ = vjlit Ди ДТ * ДМС ДТ = ДТ vcMc ’ Или Для определения химического состояния системы можно вместо молей использовать различные компоненты. Уравнение{1.37) в этом случае принимает вид: 0С- м-у = В \ Л; ••• П-Н < ° = Vjg; ПГ. = 0. ПС = ВК£、 Где y y,…?как и число молей компонента in-t, вместо (1.40) можно записать: Молярная доля компонента i определяется соотношением И вы. Щ+ ВФГ Уф-ф-ВФС Извините. hg. + ви н°+ в | Где V = Zvf.
В общем случае степень полноты реакции определялась нами для любого пакальпа composition. In в некоторых случаях, как и в первом, возникает состояние, в котором отсутствуют продукты реакции, т. е. I®,…, И* * имеет определенное определенное значение, вы можете выбрать состояние n*}^,•.Все равно-ноль. И затем… У = Н°1 Ви£; Н} = Vjl; 1 = ЮА + Ил; ПС = ВК |. Рассмотрим реакцию пары 2NH3 ^ У2 + Ж2 Для этого VNH3 = −2; vwa = 4; vh,= 3 И дним, днут дну、 -= 2 = — р = — р = д |- Если изначально pc2 и pi равны пуле, то в любой момент времени 21. Около 0_.О л \ PkN3 = » Nн3—I1CHNz 1-р— я; = I = nNH?(〜-); НСЗ. М * 0 / 3М СПГ = офе = / жит,
Дж Отсюда ясно, что 2£ / — это сумма, называемая степенью диссоциации в базовом представлении. Аналогичным образом, для ионизации слабых кислот ГА ^ Н + + Л- ДМС = −1; ВХ + −1; ва〜= 1. О, о. $ \ Пиа = «ІІА-г = Ина 1-кт» я; 1г / НЛ. Пн + = = я лил (- СП -); = е = » о О VW°га; УГА Значение/ / gn, отображаемое здесь, соответствует обычно используемой степени ионизации.
Степень диссоциации или ионизации может иметь любое значение от 0 до 1, но степень промежуточной точки реакции 2 рассматриваемых процессов может принимать значения nJIA от 0 до n ^ J 2 и 0 соответственно. Людмила Фирмаль
Может возникнуть вопрос. Почему я не ввел аналогичное значение для£/ J вместо£? 1 баночка реакции слева направо, конечно. Этот метод был принят Земанским, который ввел переменную е и назвал ее «глубиной реакции».Однако, в отличие от e, определение e далее не так просто, как определение E. It можно отнести к исходному состоянию. Еще одна важная причина введения экстремального сдвига£заключается в том, что он напрямую связан с увеличением энтропии в добровольном (необратимом) процессе, как мы увидим позже.
Смотрите также:
| Экстенсивные и интенсивные переменные | Скорость реакции |
| Свойства парциального мольного объема | Одновременно протекающие реакции |
