Пример №4-14.
Хлорид железа (III) образует три кристаллогидрата: 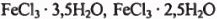 и
и 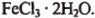 128,1 г смеси
128,1 г смеси 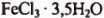 и
и 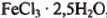 , содержащей 0,6 моль безводной соли, нагрели до 80° С. При этом кристаллогидраты расплавились и образовали гомогенный раствор. После испарения из раствора 5,4 г воды, систему охладили до комнатной температуры. При этом образовалась равновесная смесь кристаллогидратов. Определите качественный и количественный состав системы после охлаждения.
, содержащей 0,6 моль безводной соли, нагрели до 80° С. При этом кристаллогидраты расплавились и образовали гомогенный раствор. После испарения из раствора 5,4 г воды, систему охладили до комнатной температуры. При этом образовалась равновесная смесь кристаллогидратов. Определите качественный и количественный состав системы после охлаждения.
Решение:
Обозначим число молей 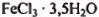 в исходной смеси через х, а число молей
в исходной смеси через х, а число молей 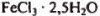 — через у.
— через у.
Тогда получаем систему уравнений:
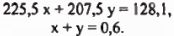
Решая систему, получаем: 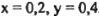
Масса безводной соли в системе составляет 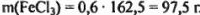 .
.
После испарения части воды в системе остается масса, равная

При этом на 1 моль соли приходится
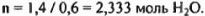
Следовательно, после испарения 5,4 г воды и охлаждения система состоит из 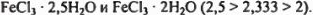 .
.
Обозначим число молей 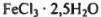 в системе после охлаждения через г, а число молей
в системе после охлаждения через г, а число молей 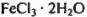 — через u. Тогда получаем систему уравнений:
— через u. Тогда получаем систему уравнений:
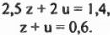
Решая систему, получаем: 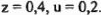
Ответ: Конечная масса смеси кристаллогидратов равна 128,1 — 5,4 = 122,7 г, из которых масса 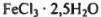 составляет 0,4 • 207,5 = 83,0 г, а масса
составляет 0,4 • 207,5 = 83,0 г, а масса 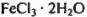 составляет 0,2 • 198,5 = 39,7 г.
составляет 0,2 • 198,5 = 39,7 г.
Этот пример взят со страницы решения задач по химии с примерами:
Возможно эти примеры вам будут полезны:
