Изменений энергии Гиббса и Гельмгольца как критерий направленности химических реакций
Энергии Гиббса и Гельмгольца позволяют оценить принципиальную возможность самопроизвольного протекания процессов. Самопроизвольно протекают только такие химические реакции, которые могут совершать полезную работу. Принято считать, что если система совершает работу, то такая работа положительная, 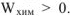 . Так как полезная работа химической реакции осуществляется за счет превращения свободной энергии в работу, т.е. за счет убыли свободной энергии, то можно записать: для изобарноизотермического процесса
. Так как полезная работа химической реакции осуществляется за счет превращения свободной энергии в работу, т.е. за счет убыли свободной энергии, то можно записать: для изобарноизотермического процесса 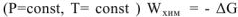 для изохорно-изотермического процесса
для изохорно-изотермического процесса 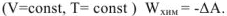 .
.
Следовательно, химические реакции самопроизвольно могут протекать только в направлении уменьшения свободной энергии системы, т.е. в направлении убыли энергии Гиббса или Гельмгольца. Поэтому критерием принципиальной возможности самопроизвольного протекания химических реакций является условие: для изобарноизотермическою процесса 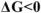 , а для изохорно-изотермических процессов
, а для изохорно-изотермических процессов 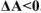 . Если
. Если 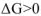 или
или 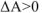 , то реакция в прямом направлении самопроизвольно протекать нс может. В этом случае самопроизвольно может протекать только обратная реакция. Если система достигла минимального значения свободной энергии
, то реакция в прямом направлении самопроизвольно протекать нс может. В этом случае самопроизвольно может протекать только обратная реакция. Если система достигла минимального значения свободной энергии 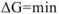 или
или 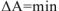 , то имеет место состояние равновесия. Поэтому условием равновесия химической реакции является: для изобарно-изотермических процессов
, то имеет место состояние равновесия. Поэтому условием равновесия химической реакции является: для изобарно-изотермических процессов 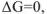 , для изохорно-изотермических
, для изохорно-изотермических 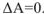 ).
).
Чем меньше алгебраическая величине 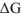 или
или 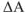 , тем дальше система находится от состояния равновесия и тем она более реакционноспособна.
, тем дальше система находится от состояния равновесия и тем она более реакционноспособна.
В большинстве случаев химические реакции проводят при постоянном давлении. Поэтому наиболее часто в качестве критерия направлснноси химических процессов используют изменение энергии Гиббса.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Соли. Классификация. Свойства. Номенклатура |
| Способы выражения состава раствора в химии |
| Факторы, влияющие на направленность химических процессов |
| Методы расчета изменения энергии Гиббса |
