Оглавление:











Изотопы
- Изотопы. Несмотря на то, что многие продукты распада радиоактивности стали известны сразу же после открытия самой радиоактивности, вопрос о принадлежности к определенной группе периодических систем элементов оставался изначально совершенно неизвестным. Это было главным образом связано с неисследованными химическими свойствами промежуточных членов радиоактивного ряда.
Примерно в 1910 году была выявлена идентификация таких химических свойств, как торий, ионы (1°) и радиоактивный торий (RdTh), радий и изотрий (MsTh). После освоения 1911-1913 гг. Закон смещения был экспериментально проверен и подтвержден определением атомного веса свинца различного происхождения.
3 ряда по химическим свойствам, что все конечные продукты разложения фактически идентичны друг другу и обычному свинцу. Людмила Фирмаль
Pb наиболее чистого (Th-свободного) образца урановых смоляных руд имеет атомную массу 206,05 и закон смещения (key-84He = ^ Pb и a32Th-64He = 208Pb).Таким образом, обычный свинец с атомным весом 207,2 представлял собой смесь по меньшей мере 2 Свинцов с различными атомными весами, но одинаковыми химическими свойствами.
С 1912 года периодический закон получил новую основу-положительный заряд ядра, поэтому разница в атомном весе продуктов конечного распада U и Th не стала препятствием для размещения их на одном и том же месте в периодической системе. Таким образом, получается, что свиги урана и тория являются изотопами, так как они имеют одинаковый положительный ядерный заряд, но различаются по массовому числу (III§ 3).
С появлением концепции изотопов исчезли и трудности, связанные с организацией продуктов радиоактивного распада в периодической системе. Действительно, все члены ряда с положительным ядерным зарядом, например 90(lo, UX, Uy, RaAc, RTH), должны находиться в той же ячейке, что и Th, независимо от атомного веса. Ядерный заряд 88 (AcX, MsTh, ThX) — это изотоп Ra и др.
Это положение было общепринятым примерно в 1915 году, но присутствие изотопов в то время было не общим правилом, а радиоактивным элементом. Подобный подход к вопросу был обусловлен установившейся концепцией абсолютного тождества всех атомов одного и того же элемента.
Идея о возможности частичного неравенства атомов выдвигалась отдельными учеными, но для их современников она казалась абсурдной фантазией, противоречащей всему химическому опыту. Открытие изотопов нерадиоактивных элементов явилось результатом детального изучения процессов, происходящих при разряде.
Еще в 1886 году мы обнаружили, что вместе с катодным лучом (III§ 2) в Разрядной трубке появляется некое излучение, идущее от анода в направлении катода. Сделайте отверстие в катоде (/С, рисунок XVI-7), эти лучи (I, rns. It удалось выпустить XVI-7) в катодное пространство и изучить его properties.
It оказывается, это потоки положительно заряженных ионов, которые образуются за счет действия катодных лучей от атомов или молекул газов в трубке. Анодная проволока называлась положительной. Как и катодный луч, они являются днем, когда они создают фотографическую версию.
Это то, что они используют, когда учатся. Положительные пучки, полученные при различных условиях, отличаются друг от друга скоростью движения частиц, их зарядом и массой. Скорость ионизации зависит главным образом от расстояния до катода и для отдельных частиц Я Мотодм * * поднять\ Анодная проволока Рисунок Xvi-7.Схема разрядной трубки.
Все по-другому. Заряд определяется числом электронов, разделенных во время ионизации. Поскольку 1-й электрон гораздо легче отделить от нейтрального, чем 2-й электрон, всегда есть положительный ион с 1-валентностью, чем 2-валентный. Наконец, месса.
Количество такого катиона практически равно массе атома или молекулы газа (или пара), находящегося в трубке. Под воздействием электрических и магнитных полей ионы, содержащиеся в составе положительных лучей, отклоняются от прямого пути. Отклонение постоянного электрического поля больше при меньшей скорости ионов и больших характеристиках отношения заряд-масса.
Если оба поля расположены определенным образом (перпендикулярно направлению луча), то все ионы, имеющие разные скорости и характеризующиеся одинаковым отношением заряда к массе (e / t), вместе дают параболу на фотопластинке. Если изменить направление обоих полей на противоположное, то можно осветить 2-ю ветвь одной и той же параболы. Схема установки исследования солнечных лучей параболическим методом (Thomson, 1913) приведена на рисунке. XVI-8, и полученная фотография имеет вид, показанный на рисунке. Xv1-9.
Исходя из природы захваченной параболы и напряжения приложенного электрического поля, можно рассчитать соотношение заряда и массы каждого типа ионов, образуемых разрядной трубкой. Из последних легко можно найти отдельные немассовые. Это невозможно с обычными химическими методами исследования, которые дают только средние значения. Область солнечного анализа очень обширна, так как газы и пары очень разных составов могут быть изучены с помощью разряда tube.
At в то же время точность параболического метода относительно невелика. Используя этот метод, мы обнаружили, что обычный неон (масса 20,2) производит параболу, соответствующую массе 20 и 22.Эта работа является первой работой, которая экспериментально показала наличие изотопов нерадиоактивных элементов. Правда, в течение следующих нескольких лет она была единственной, но не слишком много внимания.
Дальнейшее развитие этой проблемы стало возможным только в результате значительного усовершенствования параболического метода. Аналогично, изменяя относительные положения электрического и магнитного полей, можно добиться того, чтобы все ионы с одинаковым отношением заряда к массе и*могли падать на фотопластинки на 1 место в зависимости от их скорости (лето, 1919).Чувствительность метода была значительно улучшена путем замены параболической ветви на 1 малую spot. At в то же время точность определения массы отдельных частиц Опи с помощью нового прибора(масс-спектрометра) достигла 0,1%. Рисунок Xvi-8.
Схема начальной установки для исследования солнечного света. Экран Рисунок Xvi-9.Io парабола. Принципиально важным результатом масс-спектрометрических исследований явилось установление того факта, что относительный вес отдельных атомов в пределах точности измерения выражается целым числом относительно O = 16 000 (или, как сейчас принято, 2C = 12 000).Таким образом, только благодаря наличию смеси изотопов было получено дробное значение обычной практической атомной массы со многими элементами.
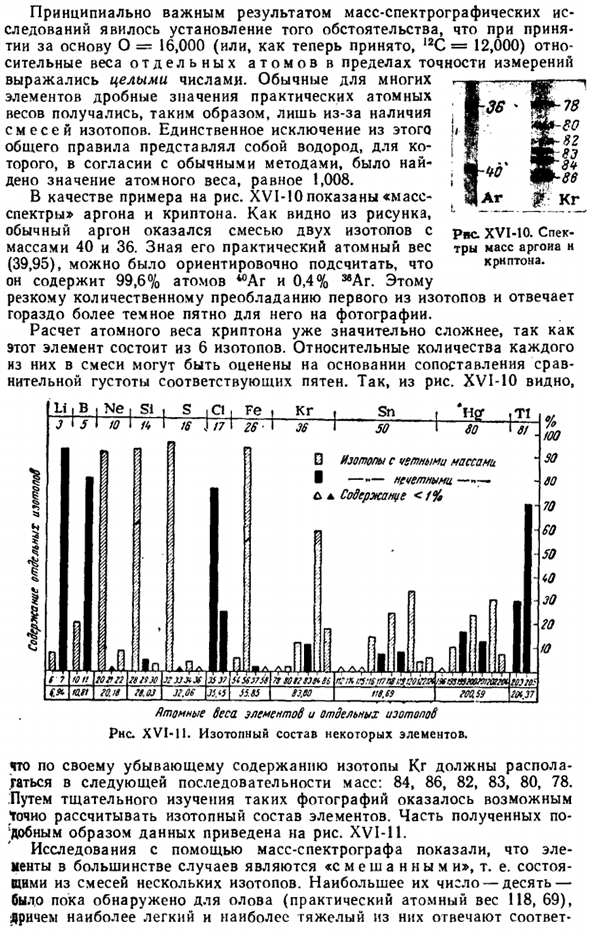
Единственным исключением из этого общего правила является водород, и согласно общепринятым методам было найдено атомное значение 1,008. В качестве примера на рисунке XVI-10 показан «масс-спектр» аргона и Krypton. As как видно из рисунка, получается, что обычный Аргон представляет собой смесь 40 и 36 изотопов с массой 2.Зная практический атомный вес (39,95), мы предварительно рассчитали, что он содержит 99,6% атомов войны и 0,4%^ Ar.
Этому резкому количественному превосходству первого изотопа соответствует гораздо более темное для него пятно на картине. Расчет атомного веса Криптона уже значительно сложнее, так как этот элемент состоит из 6 изотопов. Относительное количество каждого из них в смеси может быть оценена путем сравнения относительной плотности соответствующих пятен. Так, из рисунка. XVI-10 шоу Диаграмма XVI-10.Масс-спектры аргона и Криптона. J12l Так…
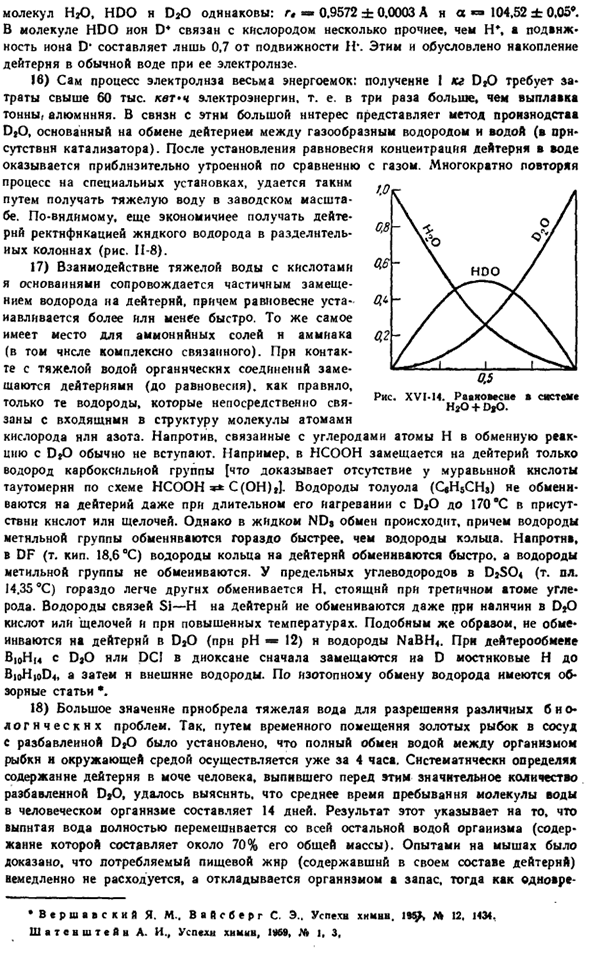
Isot изотопы с четной массой I — — — нечетным содержанием<F% Я г.:- в rsnsrviywttfsbifatitxomorm МС Мир. Я не си, С, С1, Fе, у 1 кг Ст. T1 % Так тоже 60 70 60 50 <0 JO 20 to J ■ 5 I U I / <• 16 J / 7 I 26 Тридцать шесть Пятьдесят 6! Один И затем Пирог. В БВ-дя- Горы Р! / StSX X ’ JJXJf 3С)?Яму Я ККПП » и (Ля Колея J2.CS KM I и После полудня. компания MTI //.л/ РТ. ФФ серия ms9 // Ворчливые демоны элементов и отдельных изотопов РНС. XVI-P. изотопный состав некоторых элементов. С точки зрения снижения содержания изотоп КР должен быть помещен в следующую массовую последовательность.84、86、82、83、80、78。
Тщательное изучение таких фотографий позволило нам точно рассчитать изотопный состав элементов. Некоторые из полученных таким образом данных показаны на рисунке. ХVI-11. Исследования с использованием масс-спектрометра показали, что в большинстве случаев элемент состоит из «смешанных», то есть смеси нескольких изотопов. Наибольшее их число-10-было найдено до сих пор в олове (практическая атомная масса 118, 69), а самые легкие и тяжелые из них、
Так, в обычном олове одновременно присутствуют 12 единиц атомной массы, то есть 10% различных атомов. Из других»смешанных«элементов было подтверждено наличие в массе 20 и 22 атомов, а также интересно отметить Неон, в котором было обнаружено 2 изотопа lnc (0,26% в смеси). По мере совершенствования методов исследования многие смешанные элементы открывали новые изотопы. Например, 3-й изотоп daLg(0,06%) был найден в аргоне, но в уране, помимо известных 23 «U (99,3%) и 2» U(0,7%), 23 изотопа (0,006%) были found. At в то же время количество»чистых»элементов (состоящих из атомов одинаковой массы) уменьшалось.
Именно поэтому гелий выявил 3He изотопов, но их относительное содержание составляет всего 1 к 1 миллиону. Присутствие изотопов было также обнаружено в кислороде, азоте, углероде и водороде. Относительное содержание каждого уникального индивидуального изотопа сравнивается со следующим: Е0:, В0:? 0, 4N:, 5N> * C:13C> H: * H 2670: 5: 1 270: I 90: 1 6700:1 Тяжелый изотоп водорода (2H) называется дейтерий (D). название протий было предложено для легкого изотопа (’H) (используется относительно редко).
Если сравнить данные по изотопам, то заметна резкая разница между элементами с положительным и отрицательным ядерным зарядом. Причина этого различия еще не ясна, но само его существование заставляет нас думать о»нечетных»и»четных»элементах отдельно. Из»странных» элементов многие (F, Na, AI, P и т.) классифицируются как «чистые», а остальная масса состоит всего из 2 изотопов. Последние, как правило, имеют нечетное массовое число (исключение составляют 2H, 6Li, 0B и l4N). Все » четные «элементы являются» смешанными » (исключение составляют Be и Th).как правило, каждый из них имеет более 2 (в среднем 5) isotopes.
In в последних преобладают изотопы с четным массовым числом. Хорошим примером вышесказанного послужат данные для рисунка. XVI -!Мне. Сравнивая ядерный заряд и массу отдельных изотопов различных элементов, относительное обилие их в земной коре (Ат.% ) Можно резюмировать следующим образом: Заряд ядра•.Четный-нечетный Масса……Четный, Нечетный, Четный, Нечетный. Общее содержание 73.17 25.77 1.03 0.03 Как видно из этих данных, атомы с одинаковыми зарядовыми и массовыми характеристиками распределены так сильно, что их нельзя сравнивать с атомами разных типов!。
Это, по-видимому, связано с различной стабильностью соответствующих атомных ядер. В связи с тем, что положительный заряд ядра и структура электронной оболочки идентичны, химические свойства изотопов схожи и в большинстве случаев могут считаться практически идентичными. Поэтому разделение изотопов обычно основано на различиях в физических свойствах, которые напрямую зависят от массы атома. Такое разделение наиболее полно достигается с помощью масс-спектрометра и изолируется самостоятельно Незначительное общее количество (1 порядка 1 млг в час) 4-9
Изотопы! H и 2H имеют важные характеристики, и поскольку разница масс между двумя ядрами относительно велика, они, очевидно, влияют не только на физические, но и на химические свойства. Как показывает опыт, при электролизе обычной воды водород и кислород в основном разлагают молекулу Н20 (М * = «18), а молекула 2Н20 (М = 20) накапливается в остатке. Таким образом, можно видеть, что жидкость электролита, которая активируется в течение длительного времени, усиливается с помощью 2НгО molecules.
By далее электролизируя эту жидкость в течение длительного времени и перегоняя остальное, можно получить „тяжелую воду“ почти в чистом виде. По своим характеристикам тяжелая вода существенно отличается от обычной. Температура замерзания составляет+ 3,8°C, температура кипения-101,4°C, плотность-20 ° C и составляет 1,1059 г / см*.Растворимость солей ниже, чем у обычной Н2О. Тяжелая вода не поддерживает жизни животных и растений.
Десять Разница в химических свойствах атомов H И 2H уже достаточно выражена, поэтому относительное содержание обоих изотопов природных соединений различного состава и происхождения не совсем одинаково. Начиная с тяжелой воды, вы можете получить другие производные действия. Сравните характеристические константы некоторых из них с соответствующими значениями аналогичных соединений водорода. Ч » диджей НС1 Температура плавления * С. ………- 259.2 −254.4 −114.2 Температура кипения,°С………-252.8-249.6 −84.8 Как видно из этих данных, разница между константами во всех случаях явно заметна, но в то же время невелика 1, −22
Тот факт, что большинство элементов на самом деле состоят из смеси изотопов, не влияет на многие физические свойства и делает закономерности изменения последних периодической системой менее ясными. В связи с этим нормальным атомным весом большинства элементов считается средний размер, который сам по себе не соответствует определенному типу атома.
- Из этого становится очевидным провал всех попыток найти простые численные соотношения между значениями обычных атомных весов. Однако эмпирически показано, что отдельные изотопы входят в состав этого элемента примерно в одинаковых пропорциях (с учетом отдельных исключений, связанных с радиоактивными процессами)«, поэтому нормальный атомный вес остается постоянным, а его значение полностью сохраняется в реальных химических расчетах.
С открытием изотопов стало необходимым определение самого понятия «химический элемент» (i§ 3).фактически, например, 6 изотопов Криптона можно считать любым из 6 отдельных элементов.■So, если обобщить понятие атома как соответствующего элементарного Иона, то химический элемент является、 С. Н. С Д| 6.5 6.6 80.1 79.4 ДК! −114.8 −81.6 NHj нуб −77.7 −73.6 −33.4 −31.1
Для одного и того же типа.2-я интерпретация более обоснована, так как определяющим фактором химических свойств атома является не атомный вес, а ядерный charge. Людмила Фирмаль
Положительное значение определения люфта ядра 27 Учитывая высокую распространенность изотопов среди химических элементов, естественно ожидать присутствия атомов с разными ядрами одинаковой массы. Такие изобары (с одинаковым атомным весом) известны на практике. К ним относятся 40Ag, 40K и 40Ca, 54Cg и 54Fe, 70Zn и 70Ge, etc. In в некоторых случаях 2 элемента дают 2, 3 и 4 изобары. Например, атомы с массой 124, 126, 128 и 130 известны как для Te, так и для Xe. Наличие Изобара является особенно четким признаком того, что масса самого атома не важна для его химических свойств.
Добавь 1) результаты исследования изотопного состава обыкновенной свинины интересны тем, что атомные массы Pb различного радиоактивного происхождения не равны:1,4% ФPb. 25,2%^свинец 21,7%ao7Pb и 51,7% * Pb. Из всех 4-х изотопов в результате радиоактивного распада урана, анемона или Тория не мог образоваться только Pb. Его содержание относительно невелико. Имеется монография по изотопной химии и профессиональный справочник по общим характеристикам. 2) современная масс-спектрометрия дает результаты с непревзойденным precision. In помимо решения своих основных задач (анализ изотопного состава элемента и точное определение массы атомного ядра), он используется и для многих других целей, в том числе для изучения molecules.
In в этом случае ионизация паров исследуемого вещества обычно достигается электронным ударом, и на основании полученного масс-спектра определяются масса и относительное содержание образующихся ионизированных частиц. Отметим, что масс-спектрометрия является одним из 1 наиболее чувствительных методов для обнаружения очень малых количеств вещества. Например, в ходе электронного шока metaea, в частности, ионы ч, CHJ успешно, CHJ успешно, ч+, с произойти. Каждая из них индивидуально регистрируется линиями общего молекулярно-массового спектра.
Сравнительная интенсивность линий позволяет оценить относительное количество этих ионов как 47:39: 7: 4: 1. Таким образом, было также установлено образование ионов CH (x§i добавление.171). В масс-спектрах Mn3 (CO) ω (X§ I дополнительный 84) и Co2 (CO) e (XIV§ I дополнительный 122) было подтверждено, что основными ионами являются Mn и Co, и что существует прямая валентная связь между этими центральными атомами (без карбона).Интересно, что ионы полимера были обнаружены в масс-спектрах водяного пара вплоть до [H (OH) ω]. Наиболее широко используемая молекулярно-массовая спектрометрия применяется к органическим веществам. compounds.
In по этому направлению есть монография * * * и обзорная статья 3) гелий из источника газа содержит около 8 раз sf-fc в атмосфере. Температура кипения составляет 3.195°K (для случая<he 4.215°K.). При охлаждении до −272°С сверхтекучие вещества не появляются * Броди К. И. изотопная химия. М.. Из нижней части Академии Наук СССР. 1957.595 секунд * * О л и о И. П. изотопах. М..«Наука. 1370.1231 секунд *** Beikoy J. его использование в масс-спектрометрии и органической химии chemistry.
In английский, Изд. А. А. Петрова. М.. «Мир», 1964. 704 С. Budzikevich Г. .. Dzherassya К. .. Уильям Д. интерпретация масс-спектра органических веществ compounds. In английский. И. С. Вольфсон. М. «Мир». 1966.332 секунд ••* * Полякова А. А.. Хмельницкий Р. А.. Петров А. А.. Достижения в области химии. IM. М. 9.1671. Рид р. и потом.. Достижения в области химии. 1967, Л * 12. 2209. Честь (добавлено XV§ 1.14).
Однако есть признаки сверхтекучести при 0.0055 ° К. Интересно, что изотоп гелия имеет критическую температуру смешения (v§ 2, дополнительный 21): 0.88°к- 4) принцип разделения центрифугированием применим в основном ко всем изотопам, так как из-за разницы в массе отдельные частицы подвергаются несколько различным силам. Этот метол не был широко использован в течение длительного времени, но недавно было обнаружено, что он может быть использован для разделения изотопов урана с использованием соответствующего специализированного оборудования.
Судя по информации, проникшей в открытый пресс, основным узлом установки является цилиндрическая центрифуга диаметром 15 см, вращающаяся со скоростью 5 миллионов оборотов в минуту. Из газообразных UFS, содержащихся в таких цилиндрах, более тяжелая часть (^U) накапливается несколько на стенке, а более легкая часть (^U) накапливается вблизи оси вращения. Тысячи таких единиц n, содержащихся последовательно (для увеличения степени обогащения) и параллельно (для увеличения объема концентрированных веществ), вместе составляют установки для разделения изотопов урана. 5) на основе изотопного неравенства метод разделения изотопов оказался эффективным.
Скорость CTA, при прочих равных условиях, тем меньше масса частицы, тем больше легкие атомы газообразного элемента проходят через различные микропористые перегородки несколько быстрее, чем более тяжелые one. As в результате пространство перед такой перегородкой временно обогащается тяжелыми изотопами, а пространство за перегородкой является lighter. By повторяя процесс диффузии снова и снова, мы можем, наконец, добиться очень полного разделения изотопов, составляющих исходный газ. Например, из обычного неона(атомная масса 20,2) аналогичным образом получают 0Ne и Ne, а примесей других изотопов практически нет.
Описанный способ может быть применен не только к газообразным элементам, но и к другим летучим соединениям. 6) явление теплофизики может открыть большие возможности разделения изотопов: если есть разница температур в объеме, занимаемом смесью газов (или жидкостей), то 1 вид молекулы концентрируется в холодной области, а другой 1 вид-в горячей. Поскольку простая диффузия противодействует этому изменению относительной концентрации, она обычно очень мала. Однако, эффективность разъединения может значительно быть улучшена путем использование специально конструированного equipment.
In в частности, впервые было проведено практически полное разделение изотопов хлора. 7) интересной идеей является частичное разделение изотопов в газовом потоке (rns. XVI-I2J. смесь изотопов, выходящих из звуковых конусообразных сопел, использует конический сепаратор для входа в детандер, который частично отделяет более легкие частицы от более тяжелых частиц снаружи jet. It не исключено, что повторное повторение процесса даст достаточно хороший результат. Вариант этой же идеи — «сопловой метод», схематично показанный сразу на рисунке. В XVI-13. 5 моль.%Уфе и 95 мол.%Смеси высокоскоростная струя (а) не направляется соплом (Б) на поверхность специальной формы (в).Затем、
Редкие пропорции Хм / тг, −4 ^ — ~ ~ суровое вертикальное положение,^ фиааки Рисунок XV [-12.Схематическое изображение изотопного струйного разделения. RNS-XVI-I3. Схематический вид «соплового метода». Используя нож (D), разрезать на более легкие части (D) и разрезать на изотопы » U. и некоторый концентрат по весу (£). он несколько обогащен изотопом WU. As в любом другом случае процесс должен повторяться многократно. 8) в некоторых случаях химический метод частичного разделения изотопов является эффективным.
Например, нормальный азот содержит около 99,6% 4N и только 0,4%IJN. При взаимодействии по схеме исследование распределения 5N между газообразными ионами NH и NH * (растворенная аммиачная селитра), 8NH,+, 4NH *т- » 1, NHj+, NHJ показало, что равновесие несколько сдвинулось вправо(K = 1,03). при повторном повторении этого процесса удалось увеличить содержание NH4NO3 с 9N до 73% от общего количества аммонийного азота. 9) частичное разделение изотопов может быть достигнуто электролизом.
Например, длительный электролиз расплава LiCl (непрерывная подача С1 на катод) позволил увеличить содержание Eli в катодном пространстве с обычных 7 до 20%. 10) интересный эксперимент, в котором окрашенные бактерии были помещены в тяжелую воду. За полтора года водород их организма был полностью заменен дейтерием. Бактерии адаптировались к новой среде, но нормальный процесс деления клеток бактерий был прерван, и были замечены некоторые болезненные образования, но все вернулось в норму.
Такие «дейтериевые» бактерии перестали вырабатывать красящие пигменты, но приобрели способность противостоять воздействию большого количества радиации(вредной для того же вида обычных бактерий). 11) в случае галогенидов дейтерия было найдено значение дипольного момента следующей пары (XV§ 2 add.32): 1.12 (DCI), 0.83 (DBr), 0.445 (DI). было установлено, что дейтерий-йод имеет направление момента D4I.
By электрофотографическое исследование твердого тела NDj rf (ND) −1.005 A. It это было впервые за долгое время. з ^ ДНД.. Н)-2,374 А. ЗН-Д… Н = * 164°.По-видимому, такая дейтериевая связь несколько прочнее обычной водородной связи. 12) элемент дейтерий (D»>заметно отличается от обычного водорода (Na) только своей температурой плавления и температурой кипения, например, при высокой критической температуре 5 градусов, что несколько затрудняет термическую диссоциацию молекулы(энергия диссоциации) 106,0 ккал / моль).
Длина быка в видимом спектре дейтерия несколько больше, чем у обычного водорода (около 0,3 а) равновесное соотношение орторомбического и пара-типа составляет не 3:1(рис. XV-7), а 2:1, причем оно обратно, то есть более устойчивая ортоформа. Дейтерий реагировал с Протием примерно в 4 раза медленнее. UDJ UH » меньше, чем термическая стабильность. Энергия эвнзей C-D, в среднем более чем на 2 ккал / моль больше, чем соответствующая C-H связь. 13) смешанный тип HD (mp. Водород при −251,0°с) получают взаимодействием с UA1H + 4 Dao = LiOD + AI (OD),+ 4HD D, 0 и LIAIH4 по реакции.
В молекуле был обнаружен небольшой дипольный момент в направлении H4D(μ* = 0.0009)».Несколько больший дипольный момент (0,011) является характеристикой Хжд. 14) тяжелая вода заметно отличается от обычной (помимо характеристик, описанных в тексте) многими свойствами. Поэтому значения критической температуры, диэлектрической проницаемости, поверхностного натяжения и показателя преломления несколько ниже, но вязкость выше.
Теплота ионизации тяжелой воды (14,3 ккал / моль) несколько выше, чем обычно, а ее ионные продукты ([D4J0D]-1 10″, c) несколько ниже. Максимальная плотность Djio имеет температуру 11°C. скорость испарения тяжелой воды и обычной воды трактуется как 0.65.1.Есть монография о тяжелой воде*. 15) из химических реакций тяжелой воды наиболее простой является замена Нона нормальной водой по схеме H, 0 + DDO * * 2HDO.
Очень быстро установившееся равновесие этой реакции схематично показано на рисунке. ХVI-14.Данные спектра вращательных колебаний пары (III§ 6 add.9 и 10), структурные параметры * Кврш » нбаум И. тяжелая АОДА. М от английского пер., Iadatinlyt, 1963,443 секунды Молекулы HjO, HDO и DDO одинаковы: g, 0,9572±0,0003 A и a-104,52±0,05 *. В молекулах HDO ионы D4 связаны с кислородом несколько сильнее, чем h\; не-d *подвижность составляет всего 0,7 подвижности и*.
Это связано с накоплением дейтерия в обычной воде при электролизе. 16) сам процесс электролиза очень энергоемкий. Получение ДФО в 1 кг требует более 6 млн кВт * ч электроэнергии, или в 3 раза больше стоимости алюминия production. In в связи с этим весьма интересен метод Прокнодоста ДТО, основанный на дейтериевом обмене между газообразным водородом и водой (в присутствии катализатора).После установления равновесия концентрация дейтерия в воде примерно в 3 раза превышает концентрацию газа.
Если повторять этот процесс снова и снова со специальной установкой, то можно получить тяжелую воду в заводских масштабах. Очевидно, что более экономичным является ректификация жидкого водорода в разделительной колонне для получения дейтерия (рис. II-8). 17) взаимодействие тяжелой воды с кислотами и основаниями сопровождается частичным замещением водорода дейтерием, и равновесие устанавливается почти сразу.
То же самое относится к солям аммония и аммиака(в том числе связанных комплексов).При контакте с тяжелой водой органические соединения смешиваются с дейтерием (до равновесия). как правило, смешивается только водород, который непосредственно связан с атомами кислорода или азота в молекулярной структуре. Напротив, атомы H, связанные с углеродом, обычно не имеют реакции обмена С D » 0.Например, в HCOOH только водород карбоксильной группы заменен дейтерием[согласно схеме HCOOH (OH), было доказано, что в муравьиной кислоте нет таутомера).
Водород толуола (CHH5CH) не обменивается с дейтерием при нагревании в течение длительного времени от DiO до 170ºCC в присутствии кислоты или щелочи, но в жидких NDS обмен происходит, и водород метильной группы обменивается намного быстрее, чем Кольцевой водород. DF (точка плавления 18,6 ° С) бициклический водород в дейтерии быстро обменивается, но водород метильной группы не обменивается.
Для насыщенного углеводорода DjSO (точка плавления 14.35°С) N. водород Si — Связь H обменивается с дейтерием d, 0 и не обменивается с дейтерием при DfO (pH-12) и водородом NaBH, а также, Даже если есть кислота или щелочь при высоких температурах.»В дейтериевом обмене между VyuN / 4 и DDO или DCI в диоксане первый сшитый H смешивается с D, чтобы стать BioHioD*, а затем внешний водород смешивается. Есть обзорная статья по обмену изотопов водорода. 18) тяжелая вода стала очень важной в решении различных биологических проблем. problems.
So временно поместив золотую рыбку в емкость с разбавленным D, 0, мы обнаружили, что полный обмен водой между организмом рыбы и окружающей средой уже был осуществлен в 4 hours. By систематически определяя содержание дейтерия в моче людей, ранее выпивших большое количество разбавленного ДФО, Мы установили, что среднее время пребывания молекул воды в организме человека составляет 14 дней. Этот результат показывает это. Что выпитая вода полностью смешивается со всей остальной водой организма (ее содержание составляет около 70% от общей массы).
Эксперименты с мышами доказали, что потребляемые пищевые жиры (в том числе дейтерий в их составе) не потребляются сразу, а хранятся в организме одновременно. Рисунок XVI-и4. Равновесие w против системы HgO + DO. Q5 * Ввршааски Я. М. .. Вайсберг С. Е.. Достижения в области химии. 1BSJ, M 12. 1434. Шатейштей А. И., советует по химии, 1) 169, NV|, 3、 Жир потребляется из существующих запасов. Аналогичным образом была выявлена способность животных использовать аммиачные соединения азота в синтезе белковых молекул с использованием тяжелых изотопов азота (SN).
19) в дополнение к дейтерию, изотопы других элементов могут быть использованы для выяснения различных химических проблем. Например, используя H * C1, мы обнаружили, что обмен хлора между хлористым водородом и хлоридами других элементов протекал быстро в AsCI3 и PC1$ и замедлялся в POCIj. Это очень медленно в SiCI4 или S2C) t, и он вообще не работает на CC14. С помощью 5NH$ молекулы аммиака Иона (Cu(NHj)») или[Ni(NMs)«] быстро замещаются, а non(Cr(NHj) «l» или(Co (NH)) » * » — медленно.
Имеются специализированные монографии и обзорные статьи об использовании изотопов в химии. 20) многие важные и интересные исследования были проведены с использованием изотопов кислорода (BO) и воды, полученной из него-Н2 ′ У(т. е. температура кипения 100.13 ° С). Например, реакция, которая производит сложный эфир (X§ 2), может быть done. In в общем случае для опережающего образования воды используют 2 схемы: а)из гидрокислот и гидроксильных спиртов, б) из гидрокислот и водородных спиртов.
Если первая схема верна, то при омылении эфира необходимо включить кислород*воду в полученный спирт, а если верна 2-я схема. -В составе acid. By проведение реакции омыления водой, богатой молекулами Hj, eO. It было установлено, что последнее сделано, то есть 2-я схема верна. Аналогичное исследование гидролиза триметилортофосфата выявило сильное влияние на характер протекания реакционных процессов medium. In щелочные растворы, р-О связи были в основном разрушены.
Кислотная или нейтральная «o-CH связь». 21) H2 ′ * 0 может быть использован для определения периода полуобмена молекул воды различными волнообразными катионами (рис. XVI-15).Систематические исследования неорганических соединений кислорода показали, что скорость кислородного обмена АНО снижается при переходе от свободной кислоты к кислой соли, затем к средней соли, а также при увеличении числа атомов кислорода вблизи центрального элемента подгруппы периодической системы и переходе от последней к верхней.
Изучение процесса фотосинтеза (x§ 3 доб.9) показал, что кислород, возвращающийся в атмосферу, происходит из углекислого газа, а не из углекислого газа. water. By измеряя относительное накопление углекислого газа океанского происхождения, мы можем выявить температуру, при которой углекислый газ образовывался в прошлые времена. О подобном «палеотермометрине» есть обзорная статья*. 22) замена одного изотопа на другой часто очень важна для изучения структуры молекул с помощью спектроскопии (III§ 6 add.9).
Такие замены изменяют импульс энергии молекул, но на самом деле влияют на их пространственную структуру. Это позволит вам получить больше возможностей! Ли ок’Кей «’западной долготы ЙФБ \ НЦБ РБ посетители’ SrBa \ \ второй! Се2 * 1 AI * 1 A Sc3 ’i Y3 * 1 La3′ 1 Ga3 * 1 In34 1 Tl „1 Zn2 \’ Cd ^ Hg2 * II Ni2 * Co2 * 1 I Fe2W 1 1 Cuu / sow Рисунок XVI-есть. В период полового акта происходит обмен молекул воды на катионную гидратацию (пр * 2°с). нг „г * У *“ У * го〜 ’ 1о ’ я * Рогинский. 3.
Теоретические основы изотопного метода исследования химических реакций. М. Издательство Академии Наук СССР. 1956.611 п. * * Геллер Б. А. .. Миклухонн Г. П.. Достижения в области химии. 1952 год. .V “ 7 » 08. н * т » й с Р. В. успехи в химии. 1955 год.. W 2. 1У. Исходные данные для расчета параметров структуры. Например, изотопный С1-С вариант»С-Н^ СЛ —С-С-Н»С — | ° с-СD s7CI-ПЗС микроволнового спектра различных частот (примерно 0. 76 см) поглощения, основанного на монохлорацетиле структуры параметра, найденного в (A): d(PS)= » = 1.052,d(CC)= 1.211,</(CC1)» 1.632(все±0.001 a точность).
23) хороший пример ослабления ясности проявления свойств за счет присутствия изотопов показан на рисунке. Сравнение результатов исследований паров ртути методом дифракции электронов XVI-I6.Левая сторона рисунка относится к индивидуальному изотопу wHg, а правая сторона относится к обычной ртути (то есть смеси изотопов, содержащих только 10%, 9iHg). 24) к обычным парам ртути, парам изотопа 9, кварцевой лампе, наполненной ртутью (XII§ 4 add.24) при облучении light. In в свою очередь, атомы одного и того же изотопа в основном возбуждаются.
Такие возбужденные атомы ртути реагируют с водяным паром по схеме Hg * — f HgO » = «= HgO + H».Полученный оксид ртути содержит не 10, а 15% изотопа wHg. Таким образом, была продемонстрирована принципиальная возможность фотохимического разделения изотопов. 25) интересно, что изотоп ’* Hg ’ становится сверхпроводником при несколько иной температуре (4,177°к).Чем обычная ртуть (4,156°к).
Для изотопов олова с массовыми числами 116 и 124 аналогичные температуры были найдены равными 3,767 и 3,659 ° К соответственно. Это различие может быть связано с несколько большей нулевой энергией светового изотопа (II§ 2. добавлять.10). 26) наличие изотопов дает частичное объяснение»неуместного» расположения элементов по атомному весу (Ar и K. Co и Ni, Te и I, Th и Ra).
Если в обоих элементах (или хотя бы в 1) каждой пары присутствуют изотопы, то относительное содержание отдельных изотопов оказывает решающее влияние на среднюю атомную массу. Например, рассмотрим случай аргона (атомный вес 39,9) и Карнии (атомный вес 39,1).в каждом из них имеется по 3 изотопа. Количество последних (по числу атомов) определяется следующим соотношением: 5 * Ar:1 mAh:1580 ^ Ar и 7890 WK: I ^ KGBO 4, K. In в первом случае резко преобладает более тяжелый изотоп, во втором-более легкий. Таким образом, средняя атомная масса аргона больше, чем калия.
27) из приведенного выше текста следует, что каждое место периодической системы (по крайней мере, в случае»смешанного»элемента) содержит»галактику»атомов с различными массовыми числами. Размещение такой галактики в 1 месте без нарушения общих характеристик системы возможно только в том случае, если она построена во Вселенной, а не в плоскости. Подобный переход от 2D к 3D можно считать дальнейшим развитием периодического закона.
Смотрите также:
| Соли кислородных кислот | Состав атомных ядер |
| Естественная радиоактивность | Превращение элементов |
