Электролиз зависит от потенциала электрода и плотности тока. Поляризационная кривая — это графическое изображение результатов изменения потенциала электрода во время прохождения тока в зависимости от плотности тока (диаграмма Эванса).
Поляризация увеличивает подачу напряжения на клеммы электролизера. Различают химическую и концентрационную поляризации.
Химическая поляризация возникает вследствие того, что выделение продуктов электролиза на электродах изменяет химическую природу электродов.
Рассмотрим электролиз водного раствора 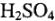 на платиновых электродах:
на платиновых электродах:
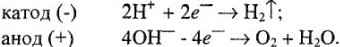
На катоде происходит выделение водорода 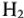 , на аноде -кислорода О2. Выделяющиеся водород и кислород приводят к возникновению водородно-кислородного гальванического элемента с ЭДС, направленной против внешней ЭДС. Здесь водородный электрод
, на аноде -кислорода О2. Выделяющиеся водород и кислород приводят к возникновению водородно-кислородного гальванического элемента с ЭДС, направленной против внешней ЭДС. Здесь водородный электрод 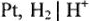 играет роль анода в гальваническом элементе, а кислородный электрод
играет роль анода в гальваническом элементе, а кислородный электрод 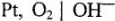 — роль катода. Образующиеся кислород и водород изменяют потенциал электродов. На катоде к потенциалу кислородного электрода в кислой среде следует прибавить перенапряжение 0,7 В, а на аноде от потенциала водорода в кислой среде следует отнять перенапряжение 0,07 В. Общая сумма поляризации составит 0,63 В.
— роль катода. Образующиеся кислород и водород изменяют потенциал электродов. На катоде к потенциалу кислородного электрода в кислой среде следует прибавить перенапряжение 0,7 В, а на аноде от потенциала водорода в кислой среде следует отнять перенапряжение 0,07 В. Общая сумма поляризации составит 0,63 В.
Таким образом, поляризация и появление нового гальванического элемента при электролизе требуют дополнительного расхода энергии. Концентрационная поляризация возникает
вследствие того, что по мере протекания электролиза концентрация электролита в анодном и катодном пространствах изменяется. Так, при электролизе водного раствора сульфата меди 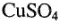 на медных электродах происходят следующие процессы:
на медных электродах происходят следующие процессы:
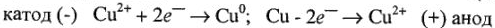
В результате электролиза концентрация ионов меди 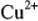 на катоде уменьшается, а на аноде возрастает, что приводит к образованию гальванического элемента с ЭДС, направленной против приложенной разности потенциалов.
на катоде уменьшается, а на аноде возрастает, что приводит к образованию гальванического элемента с ЭДС, направленной против приложенной разности потенциалов.
Поляризация — явление нежелательное (хотя иногда и полезное), поскольку вызывает необходимость добавочного напряжения, т.е. повышения напряжения для преодоления ЭДС возникшего поляризованного элемента.
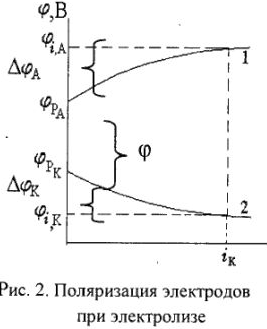
Наименьшее напряжение тока, при котором практически протекает процесс электролиза в данных условиях, называют потенциалом разложения (фраг1). Потенциал разложения имеет огромное практическое значение, так как позволяет проводить разделение элементов, выделять металлы.
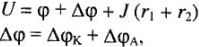
где U — напряжение, 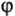 — ЭДС,
— ЭДС,
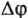 — поляризация анода и катода,
— поляризация анода и катода, 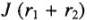 падение напряжения в проводниках первого и второго родов; 1 — анод, 2 — катод.
падение напряжения в проводниках первого и второго родов; 1 — анод, 2 — катод.
Избыточное напряжение, которое необходимо приложить к электролизной ванне сверх ее равновесной ЭДС для проведения электролиза, называется перенапряжением (ij) — это разность между ‘ значениями потенциала разложения опытного и теоретически рассчитанного.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Электролиз расплавов в химии |
| Электролиз водных растворов в химии |
| Поляризация в химии |
| Законы электролиза (фарадея) в химии |
