Коррозия металлов
Коррозия металлов — процесс самопроизвольного разрушения (окисления) металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой.
Сущность коррозионных процессов сводится к переходу металлов в более стабильные термодинамические продукты (оксиды, гидроксиды, основные соли и тд.), в виде которых они встречаются в природе. На извлечение металлов из природных руд затрачивается энергия (в доменном процессе, при электрометаллургическом получении и т.д.), поэтому обратное превращение чистых металлов в окисленное состояние протекает с освобождением энергии. Все коррозионные процессы имеют общую причину — термодинамическую неустойчивость металлов в условиях воздействия внешней среды. Металлы, встречающиеся в природе в чистом виде (золото, платина и др.), < обычно, если условия их использования не слишком отличаются от природных, не коррозируют.
В результате коррозии металлы становятся менее прочными, изменяются размеры изделий из них, увеличивается работа при трении между деталями машин. Даже самая малая степень коррозии какой-нибудь ответственной детали может вывести из строя многие точные приборы (часы, установки по автоматическому управлению производственных процессов и т.д.). Электрические и магнитные свойства металлов при коррозии ухудшаются.
Коррозия приносит колоссальный ущерб всем отраслям, поэтому изучение коррозии и методов защиты от нее имеет большое значение.
Различают химическую, биохимическую и электрохимическую коррозию металлов.
Химическая коррозия, например, наблюдается при горячей обработке металлов: 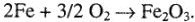
Здесь электроны переходят непосредственно с атома металла на частицу окислителя, нет пространственного разделения процессов окисления и восстановления, а поэтому и не возникает электрический ток. Химическая коррозия протекает в сухих газах и жидкостях, не имеющих заметной электропроводности.
Биохимическая коррозия вызывается жизнедеятельностью различных микроорганизмов, использующих металл как питательную среду или выделяющих продукты (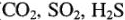 и др.), разрушающе действующие на металлы.
и др.), разрушающе действующие на металлы.
Электрохимическая коррозия встречается чаще других видов коррозии и особенно опасна для металлов. Она может протекать в газовой атмосфере — тогда на поверхности металла возникает конденсация влаги (атмосферная коррозия); в почве (почвенная коррозия) и в растворах (жидкостная коррозия), т.е. во всех случаях, когда возникает контакт металла с электролитом.
При контакте металла с электролитом (рис. 5) поверхность металла дифференцируется на участке с более низким (анодным) и более высоким (катодным) потенциалом. На анодных участках идет процесс окисления металла: 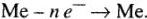
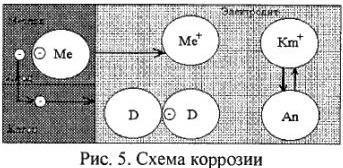
Образовавшиеся ионы металла из кристаллической решетки переходят в раствор в виде гидратированных ионов. Электроны остаются на металле.
На катодных участках идет восстановление окислителей. Избыточные электроны, проявившиеся в металле, связываются чаще всего молекулами кислорода или ионами водорода (деполяризаторы), присутствующими в среде.
В связи с этим различают:
1) коррозию с деполяризацией ионами водорода:
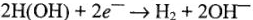 (в нейтральной среде)
(в нейтральной среде)
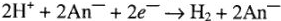 — (в кислой среде)
— (в кислой среде)
 — условное обозначение кислоты;
— условное обозначение кислоты;
2) коррозию с кислородной деполяризацией:
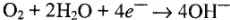 (в щелочной, нейтральной среде)
(в щелочной, нейтральной среде)
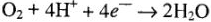 (в кислой среде).
(в кислой среде).
На катоде может идти одновременно восстановление кислорода и ионов водорода.
В случае электрохимической коррозии наряду с химическими процессами (отдача и присоединение электронов) протекает электрический процесс — переход электронов от анодных участков металла к катодным, т.е. в системе возникает электрический ток.
Вследствие электрохимической неоднородности на поверхности коррозирующего металла образуется более или менее сплошная система макро- или микрогальванических элементов. Причины электрохимической неоднородности: различные включения в металле, дефекты структуры оксидной пленки, неравномерность распределения продуктов коррозии, различная обработка поверхности, неравномерный доступ кислорода, различная концентрация электролита, различная температура и т.д.
Итак, электрохимическая коррозия металлов может рассматриваться как суммарный результат работы микрогальванических элементов, возникающих на поверхности металла при соприкосновении с растворами или расплавами электролита.
Математически условие коррозии с выделением водорода можно записать в виде: 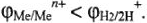
Если это условие выполнено, то коррозия происходит в результате работы микрогальванических элементов:
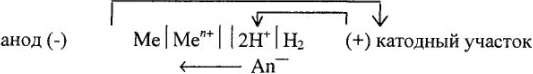
Условие коррозионного растворения металла за счет кислорода: 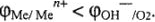
Схема гальванического элемента:
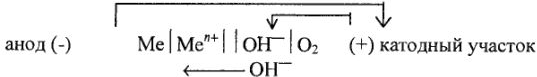
Электродный потенциал металла в данных условиях можно рассчитать по формуле Нернста, если известна активность ионов металла в данном растворе. Если же активность ионов в данной среде неизвестна, то электродный потенциал металла приходится определять опытным путем.
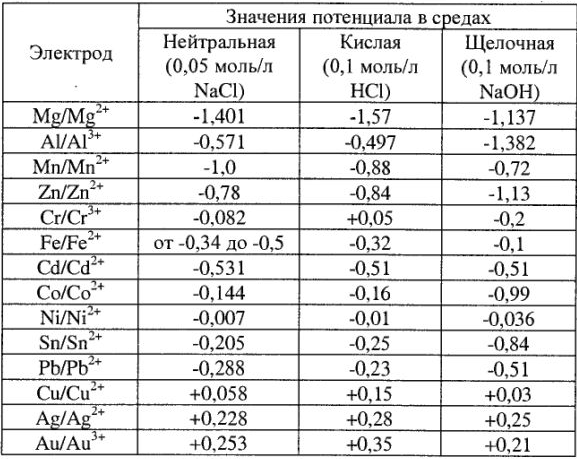
Значения электродных потенциалов ряда металлов в растворах различных электролитов приведены в табл. 20.
Электродные потенциалы водородного и кислородного электродов вычисляют по формуле Нернста, принимая во внимание катодные процессы:
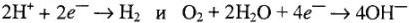
Для водородного электрода:
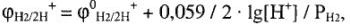 , где
, где 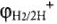 — нормальный потенциал водородного электрода при данных условиях;
— нормальный потенциал водородного электрода при данных условиях; 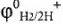 — нормальный электродный потенциал водородного электрода;
— нормальный электродный потенциал водородного электрода; 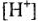 — концентрация (активность) ионов водорода в растворе, моль/л;
— концентрация (активность) ионов водорода в растворе, моль/л; 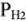 — парциальное давление газа водорода над раствором.
— парциальное давление газа водорода над раствором.
Таблица 20
Для кислородного электрода:
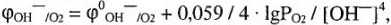
где 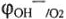 — нормальный потенциал кислородного электрода при заданных условиях;
— нормальный потенциал кислородного электрода при заданных условиях; 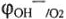 — нормальный электродный потенциал кислородного электрода;
— нормальный электродный потенциал кислородного электрода; 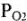 — парциальное давление газа кислорода над раствором;
— парциальное давление газа кислорода над раствором; 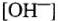 — концентрация ионов
— концентрация ионов 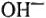 в растворе.
в растворе.
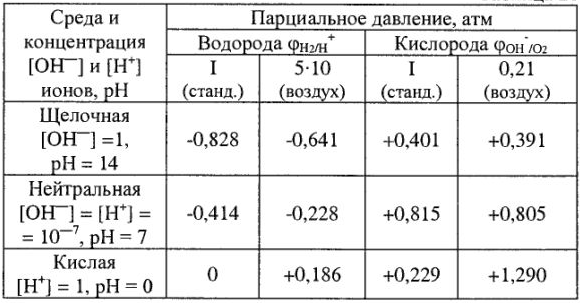
Значения электродных потенциалов водородного и кислородного электродов при различных концентрациях 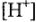 и
и 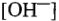 в растворе, при различных парциальных давлениях газов
в растворе, при различных парциальных давлениях газов 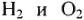 (без учета перенапряжения) при 25 °C (табл. 21) справедливы только в том случае, когда процессы
(без учета перенапряжения) при 25 °C (табл. 21) справедливы только в том случае, когда процессы 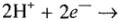
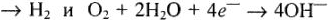 идут на платине, покрытой платиновой чернью. На любом другом материале потенциал этих процессов смещается в отрицательную сторону на значение перенапряжения
идут на платине, покрытой платиновой чернью. На любом другом материале потенциал этих процессов смещается в отрицательную сторону на значение перенапряжения 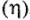 . Например, потенциал водородного электрода в кислой среде на воздухе
. Например, потенциал водородного электрода в кислой среде на воздухе 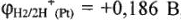 , если восстановление ионов водорода идет на платине; если же водород выделяется на графите (перенапряжение водорода на графите — 0,65 В), его потенциал
, если восстановление ионов водорода идет на платине; если же водород выделяется на графите (перенапряжение водорода на графите — 0,65 В), его потенциал 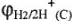 = 0,186 — 0,65 = -0,464 В, т.е. перенапряжение уменьшает окислительную активность водородного и кислородного электродов; потенциал электродов становится более отрицательным.
= 0,186 — 0,65 = -0,464 В, т.е. перенапряжение уменьшает окислительную активность водородного и кислородного электродов; потенциал электродов становится более отрицательным.
Таблица 21
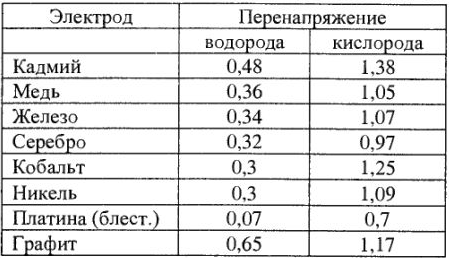
Значения перенапряжения водорода и кислорода на различных металлах при плотности тока 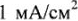 приведены в табл. 22.
приведены в табл. 22.
Таблица 22
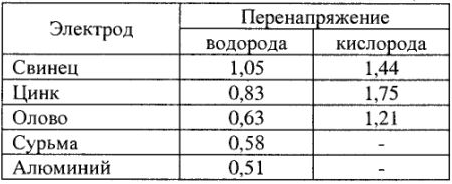
Окончание табл. 22
Расчет электрохимической коррозии рекомендуется проводить следующим образом:
1. Устанавливают анодные и катодные участки. Для этого выписывают из табл. 20 значения электродных потенциалов металлов, находящихся в контакте, с учетом среды. Металл, имеющий более отрицательное значение электродного потенциала, — возможный анод. Второй металл может выполнять роль подкладки для катодного процесса. (Иногда роль подкладки играют оксидная пленка, включения углерода, карбиды и т.д.)
2. Определяют электродные потенциалы возможных окислителей  с учетом среды и материала катода:
с учетом среды и материала катода:
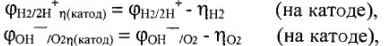
где 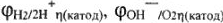 — электродный потенциал водородного (кислородного) электрода в данной среде с учетом перенапряжения водорода (кислорода) на материале катода;
— электродный потенциал водородного (кислородного) электрода в данной среде с учетом перенапряжения водорода (кислорода) на материале катода; 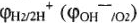 — электродный потенциал водорода (кислорода) в данной среде (см. табл. 21);
— электродный потенциал водорода (кислорода) в данной среде (см. табл. 21); 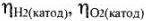 — перенапряжение водорода (кислорода) на материале катодного участка (табл. 22).
— перенапряжение водорода (кислорода) на материале катодного участка (табл. 22).
3. Сравнивают 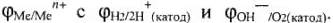 — Если
— Если 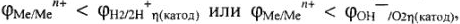 то коррозия возможна.
то коррозия возможна.
4. Составляют схему микрогальванического элемента, в результате работы которого коррозирует металл:
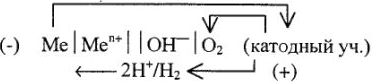
Следует иметь в виду, что катодными участками могут быть не только включения менее активного в данных условиях металла, но и различные неметаллические включения, оксидные пленки и т.д.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Законы электролиза (фарадея) в химии |
| Выход по току в химии |
| Защита металлов от коррозии в химии |
| Комплексные соединения в химии |
