Оглавление:






Кривая ток-потенциал
- Кривая ток-потенциал Вольтамперометрия основана на изучении поляризационных или вольтамперометрических кривых (кривых зависимости интенсивности тока от напряжения). Это получается, когда напряжение постепенно увеличивается, а интенсивность тока фиксируется во время электролиза раствора образца. Электролиз должен выполняться с использованием легко поляризуемых электродов с небольшими поверхностями, где происходит электровосстановление или электроокисление вещества.
- Использование вольт-амперных кривых в аналитических целях началось в 1922 году с разработки метода полярографического анализа чешским ученым Я. Гейровским. Ю. Гейровский электролизуется ртутным капельным электродом, а вольтамперометрия, связанная с использованием ртутного капельного электрода, получила название р-полярографии.
С открытием и развитием этого метода Дж. Гейловский получил Нобелевскую премию в 1959 году. Людмила Фирмаль
Рассмотрим электролиз в системе, где ртутно-капельный электрод функционирует в качестве катода, а на практике неполяризуемый каломельный электрод действует в качестве анода. Изменение внешней ЭДС в такой системе является полностью изменением потенциала катода.
Если в растворе нет вещества, которое можно восстановить под воздействием тока, интенсивность тока / пропорциональна приложенному напряжению E (закон Ома) / = £ //? , Где R сопротивление. Если в исследуемом диапазоне напряжений на ртутном электроде имеется вещество, которое может быть восстановлено, форма кривой зависимости напряжения от тока существенно меняется.
Когда достигается восстановительный потенциал, часто образуется амальгама, и ионы начинают разряжаться на ртутном катоде. Mn + — \ — ne к + Hg = M (Hg) (10,1) Потенциал (10.1) ртутного катода, где протекает обратимый процесс, выражается уравнением Нернста. E = E ° + -Wr \ n, (10,2) 1 нф CtYa с в — концентрация амальгамы. Ya — коэффициент активности. см — концентрация восстановленных ионов в слое рядом с электродом (ионный заряд для простоты опущен).
Ym — коэффициент активности; aHg — ртутная активность амальгамы. E ° — стандартный электродный потенциал (JL). В результате процесса (10.1) интенсивность тока в цепи начинает увеличиваться, а концентрация восстанавливающих ионов на поверхности капли ртути уменьшается. Однако диффузия из массы раствора приводит к отправке новой порции ионов на поверхность капли.
Интенсивность тока в цепи зависит от скорости диффузии и пропорциональна разности между массой раствора (см) и концентрацией слоя рядом с электродом (см), а интенсивность тока / пропорциональна этой разности. / = (Ю.З.) Вклад других недиффузионных механизмов проникновения ионов в катодный слой в условиях большого избытка несоответствующего фонового электролита незначителен.
В недиффузионных процессах основное значение имеет перенос ионов на катод под действием электрического поля. Если ток перехода из-за этого процесса не устранен, общий ток не контролируется. Ток миграции подавляется путем введения в раствор так называемой достаточно безразличной концентрации, которая не участвует в электродной реакции, независимо от того, имеется ли намного больше фонового электролита.
Отрицательный потенциал эмиссии, чем анализируемые ионы. Катионы в фоновом электролите экранируют электрод, тем самым уменьшая движущую силу для движения под воздействием электрического поля практически до нуля. При определенном катодном потенциале концентрация ионов на поверхности капли ртути Cm уменьшается до незначительного уровня по сравнению с концентрацией массы раствора, а скорость разряда ионов на катоде равна скорости диффузии.
Электролиз происходит при очень низкой интенсивности тока (приблизительно 10-5 А), и концентрация восстанавливающих ионов на глубине раствора постоянна, поскольку концентрация катодного слоя близка к нулю. Следовательно, разность концентраций, которая определяет скорость диффузии при определенной температуре, постоянна, а поток ионов к катоду постоянен.
Начало уравновешивания характеризуется постоянной силой тока, которая не изменяется при дальнейшем увеличении напряжения. Этот постоянный ток, контролируемый диффузией, называется диффузией и обозначается Id. Уравнение для интенсивности диффузионного тока получается из уравнения (10.3) с cm = 0. Id = (10,4) Интенсивность диффузионного тока прямо пропорциональна концентрации восстанавливающих ионов в массе раствора.
- Объединение уравнений (10.3) и (10.4) / = / d-LmSm или (U.5) Концентрация амальгамы, образовавшейся в результате процесса (10.1), пропорциональна силе тока. Ca == k’j = -L-. (10.6) Назначьте соотношения (10.5) и (10.6) в уравнение (10.2). ■ F = £ ° 4-ffl In ~ *) YM * a (10-7) нф квт * Некоторые значения в этой формуле либо постоянны, либо зависят только от температуры.
Поэтому амальгама, образующаяся при электролизе на ртутном катоде, настолько разбавлена, что ртутная активность амальгамы aHg практически равна активности чистой ртути, то есть значение является постоянным. Коэффициент активности ионов сердца при постоянной ионной силе, создаваемой фоновым электролитом, остается постоянным, так что коэффициент активности равен ul, а коэффициенты — km и k.
Это полярографическое волновое уравнение, а величина £ «/ j называется полуволновым потенциалом. Людмила Фирмаль
Согласно (10.7), это количество зависит только от температуры и имеет следующий вид £ = £ 0 + в L + * L \ n J ± Z ± (10,8) нФ к виВа нФ I v 9 Или r, n, RT. Я, — / £ = + ln / -1 ‘(10,9) где £ / f = дюймы (10.10) Я Уравнение (11.9) показывает зависимость приложенного напряжения от силы тока во время процесса обратимого электрода.
На рисунке показана типичная зависимость силы тока от приложенного напряжения. 10.1. Это полярографическая волна (полярограмма). На рисунке показано, что в начале процесса, если потенциал катода мал, интенсивность тока медленно увеличивается с увеличением потенциала — это так называемый остаточный ток, который составляет порядка 10-7 А.
Когда потенциал восстановления достигается на катоде, начинается разряд ионов, ток быстро увеличивается и стремится достичь предельного значения диффузионного тока. / = = {hid, уравнение (10.9) E = E./e Как и (10.10), это соотношение показывает, что полуволновой потенциал не зависит от интенсивности тока и, следовательно, от концентрации восстанавливающих ионов.
Таким образом, полуволновой потенциал является качественной характеристикой ионов в растворе определенного фонового электролита, а определение полуволнового потенциала является основой для качественного полярографического анализа. Однако полуволновой потенциал сильно зависит от фоновой среды электролита, природы и концентрации.
Особое значение имеет наличие в растворе веществ, способных образовывать комплексы с определенными ионами. Из-за присутствия лиганда в исследуемом растворе полуволновой потенциал сдвигается в отрицательную область и используется для определения состава и константы стабильности координационного соединения.
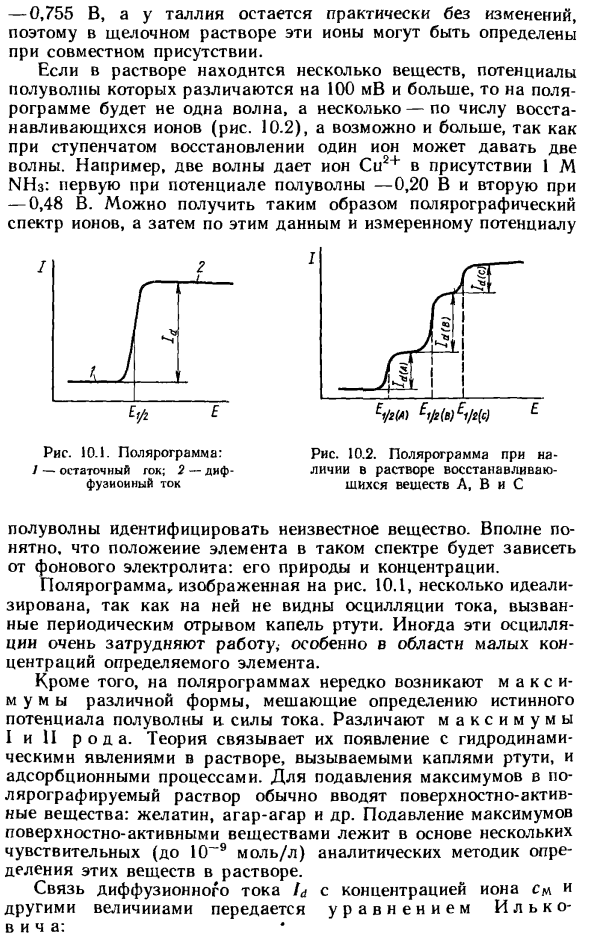
Сдвиг полуволнового потенциала при введении лиганда в раствор значительно расширяет возможности полярографического анализа и позволяет создать условия для измерения нескольких компонентов в одном растворе без предварительного разделения , Например, при 1 M KO ионы свинца (II) и таллия (I) имеют полуволновые потенциалы -0,435 и -0,483
В соответственно, и отдельные измерения не могут быть выполнены на этом фоне. В 1 М NaOH полуволновой потенциал свинца равен Поскольку -0,755 В и таллия изменяются очень мало, в щелочных растворах эти ионы могут быть определены по наличию соединений. Если в растворе несколько веществ и их полуволновые потенциалы различаются более чем на 100 мВ, полярограмма будет иметь несколько волн по числу восстанавливаемых ионов вместо одной волны (рис. 10.2).
Две волны могут генерироваться с одним ионом. Например, две волны генерируются ионами Cu2 + в присутствии I M NH3. Первый полуволновой потенциал -0,20 В, другой -0.48V. Полярографический спектр ионов может быть получен этим методом. Я 1 » A | , _ .1 .., * 1/2 (A) Ep (b) E1 / г [с] Рисунок 10.2.
Полярограмма в присутствии восстанавливающих веществ A, B, C в растворе Полуволна идентифицирует неизвестные вещества. Понятно, что положение элемента в таком спектре зависит от фонового электролита, его природы и концентрации. Полярограмма YL, показанная на рисунке, несколько идеализирована, поскольку колебания тока, вызванные периодическим разделением капель ртути, невидимы.
Эти вибрации делают работу очень трудной, особенно в областях, где концентрация измеряемого элемента низкая. Кроме того, полярограммы часто имеют максимальные значения различных форм, которые мешают определению истинного полуволнового потенциала и силы тока. Различают максимальные значения типов I и II. Теория коррелирует их появление с гидродинамическими явлениями в растворе, вызванными каплями ртути и процессами адсорбции.
Для подавления максимального значения в поляризационный раствор обычно вводят поверхностно-активные вещества: желатин, агар и т. Д. Подавление максимальных значений поверхностно-активными веществами и веществами является основой нескольких чувствительных (до 10-9 моль / л) аналитических методов, которые определяют эти вещества в растворе.
Связь между диффузионным током / 05zDl / * m ‘/ 4’, ткм Где z — ионный заряд. D — коэффициент диффузии. m — масса ртути, вытекающей из капилляра (I s, мг). t — время образования капли (период капли). Из величин, содержащихся в этом уравнении, коэффициент диффузии D наиболее трудно определить экспериментально, и использование соответствующих справочных данных не всегда возможно.
Поэтому коэффициент пропорциональности между концентрацией вещества и интенсивностью диффузионного тока обычно устанавливается с использованием стандартного раствора. Конечно, при постоянных условиях поляризации Z) m и t постоянны, и уравнение (10.11) имеет вид = (10.12) В этом отношении так называемые капиллярные свойства, рассчитанные как rnhtl, всегда проявляются в полярографических исследованиях. (10.11)
Смотрите также:
Решение задач по аналитической химии
| Общая характеристика потенциометрического метода | Схема полярографической установки |
| Задачи по потенциометрическому методу | Прямая полярография |
