Оглавление:

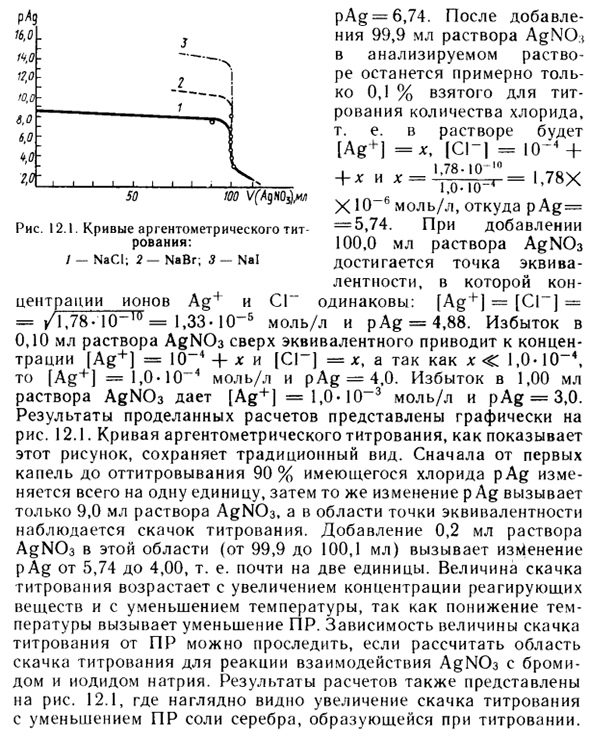

Кривые титрования в аргентометрии
- Кривая титрования В аргентометрии кривые титрования обычно строятся с координатами pAg-V. Где p Ag — логарифм концентрации иона Ag *, взятый с противоположным знаком, а V — объем титранта. AgN03 или KSCN действует как титрант и может использовать раствор NaCl.
- Рассчитайте кривую титрования 100,0 мл 0,10 М раствора NaCl, содержащего 0,10 М раствора AgNOa. В водном растворе NaCl он полностью диссоциирует, поэтому концентрация иона хлорида С1 в начале кривой титрования, когда титрант еще не добавлен, представляет собой концентрацию NaCl, т.е. 0,10 моль / л и p C1 = 1,00.
Для простоты предполагается, что объем раствора не изменяется во время титрования и разница между активностью и концентрацией ионов невелика. Людмила Фирмаль
Будет равным Когда к NaCl добавляют 1,00 мл раствора AgN03, образуется осадок AgCl, снижая концентрацию С1 до хлорид-ионов в растворе. Равновесная концентрация ионов в растворе будет: [Ag *] = [CI «*] = 0,099 + * — [CI 1 = 1,78 * 10 10 моль / л, запись по правилу продукта растворимости [Ag4] Вы можете: x (x + 0.099) = 1.78-10, почему x = = | Ag + I = 1.70.099 ‘=! .8’10 «9 моль / л, или p Ag = 8,74.
При добавлении 90,0 мл раствора AgNCh около 90% хлорида связывается с осадком AgCl и поддерживает равновесие в растворе. Концентрация [Ag +] = x и [01] = 0.01 + x, значения, полученные из PR: x = = [Ag +) = 1’10 ‘Sh. ? = 1,78-1,0 ^ * моль / л, это соответствует p Ag = 7,74. При добавлении 99,0 мл AgNCb концентрация ионов в растворе составляет [Ag4] = x, [C1 «| = 1,0-10-3 +. + *, Whyence x = [Ag4) = ‘j’ ^ ‘J ^ ■ -1,78-10 «7 моль / л или рЛД pAg = 6,74.
После добавления Если в анализируемом растворе найдено 99,9 мл раствора AgNO *, остается только около 0,1% количества хлорида, используемого для титрования. То есть решение [Ag +] = *, [C1 «| == 1 (T4 + ………. N .__ и ^ n: 1n-T = U78X 1.0.10 » XI O «6 моль / л, где p p Ag: Рисунок 12.1. Кривая титрования серебра составляет -5,74. При добавлении катионов: 100,0 мл раствора AgN03 / -NaCI; 2 — NaBr; 3-Nal достигнутая точка.
- Полнота с одинаковой концентрацией ионов Ag + и ионов SG: [Ag = [SG] == / 1,78-10 10 = 1,33-10 до 5 моль / л и pAg = 4,88. мл будет иметь концентрацию [Ag +) = 10-4 + x и [SG] = x, если x <1,0-10- \ [Ag4 «] = 1,0,10» 4 моль / л и pAg = 4,0 Избыток 1,00 мл раствора AgN03 дает [Ag +] = 1,0-10 ± 3 моль / л и pAg = 3,0. Результаты расчетов показаны графически на рисунке 12.1. Как показано на этом рисунке, титрование серебра сохраняет традиционный внешний вид.
Такое же изменение в единице, p Ag, вызывает только 9,0 мл раствора AgNCh, и в области точки эквивалентности наблюдается быстрое увеличение титрования. При добавлении 0,2 мл раствора AgN03 в эту область (от 99,9 до 100,1 мл) pAg составляет от 5,74 до 4,00, то есть почти 2 единицы.
От первого титрования до титрования 90% доступного хлорида pAg изменяется на единицу. Людмила Фирмаль
По мере снижения температуры PR уменьшается, поэтому скачок титрования увеличивается с увеличением концентрации реагента и понижением температуры. Рассчитав площадь скачка титрования для реакции AgNCh с бромидом и йодидом натрия, можно проследить зависимость величины скачка титрования от PR.
Результаты расчетов также показаны на рисунке. На 12.1 наблюдается явное увеличение скачка титрования при уменьшении PR соли серебра, образующейся во время титрования. 16,0 17,0 Около 6,0 г 50100 В (AgH0j} / U
Смотрите также:
Решение задач по аналитической химии
| Задачи по комплексометрическому тетрованию | Индикаторы в аргентометрии |
| Аргентометрия | Практическое применение аргенометрии |
