Оглавление:

Характерные признаки
МЕТАЛЛЫ (от греч. Metallon-первоначально шахта, шахта), in-va, обладает свойствами в нормальных условиях, металлами и высокими электрическими свойствами. Проводимость и теплопроводность были отклонены. Температурный коэффициент.
Электропроводность, способность в достаточной степени отражать световые волны (глянец), пластичность. Металлы включают в себя как сам металл (отдельно), его сплавы, так и соединения металлов. Интерметаллическое соединение. Также называется металлом.
Любой остров, который содержит любой металл. По тебе, например, так называемые «синтетические» металлы (см. Интеркаляция), металлоорганические.
Блеск, пластичность, пластичность — «Яркий ковкий предмет» (М.В. Ломоносов) ранее считался металлическим элементом. Но металл. Некоторые неметаллы, такие как йод. Хрупкие металлы известны, но есть много других. Со временем в результате тщательной очистки они были получены в пластиковом виде.
В настоящее время наиболее важные признаки металлов воспринимаются как негативные. Температурный коэффициент.
- Электропроводность, то есть электропроводность, связанная с трехкратным ростом, который снижает электричество. Из 109 элементов, которые являются периодическими. Система 86 классифицируется как металл. Периодические металлические и неметаллические граничные таблицы (длинная версия) рисуются по диагонали от B до At.
Не существует единого мнения по некоторым элементам, например, Ge, Sb, но, тем не менее, правильно считать Ge неметаллическим. Ему принадлежит полупроводник sv-you, физический, но Sb-металл. Святой Антоний — полуметалл.
Олово существует как в металлической (b-Sn), так и в полупроводниковой (a-Sn) модификациях. С другой стороны, Ge, Si, P и другие неметаллы высокого давления выявили модификацию металла. Проводимость.
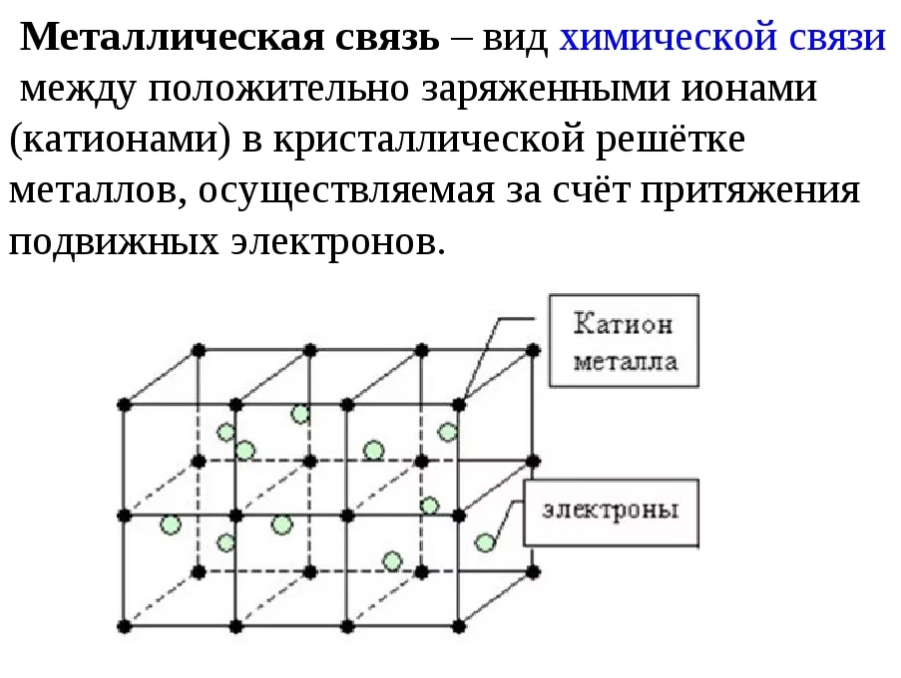
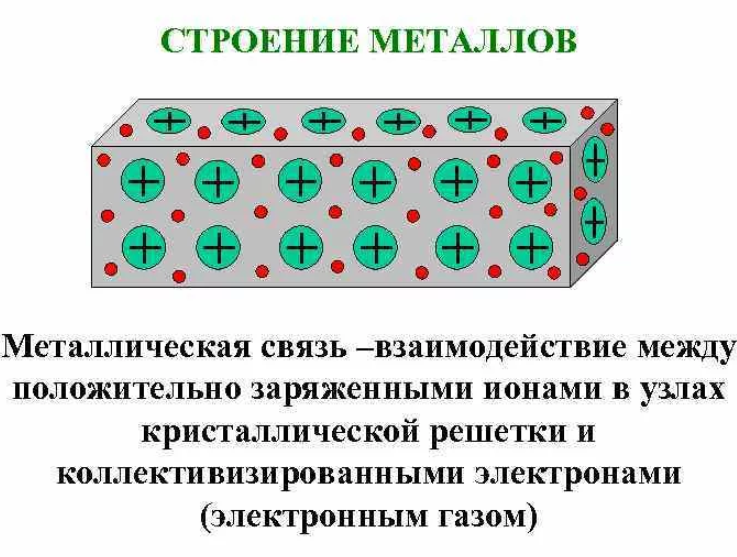
В металлах существует металлическая связь
При достаточно высоких давлениях можно предположить, что все островки могут приобретать металлические свойства. УО.
Поэтому вопрос о назначении того или иного элемента металлу или неметаллу должен быть четко определен исходя из соображений, а также физических факторов. Санкт-ин-ва, а также его химические вещества. св. Термин «металлоид» иногда используется для элементов на границе между металлом и неметаллом, но этот термин не рекомендуется в химии.
Металлы имеют металлические связи, которые являются кристаллическими.
С другой стороны, валентные электроны делокализованы по всему пространству решетки. Металлы могут быть представлены в виде сложенных скелетов.
Ионы погружены в «электронный газ», который компенсирует силы отталкивания. Ion. Энергия этих делокализованных электронов проводимости соответствует зоне проводимости. Согласно теории зон, металлы не имеют запрещенной зоны между валентной зоной и зоной проводимости.
В металлических кристаллах атомы ионизуются только частично, а некоторые валентные электроны остаются связанными, поэтому между соседними атомами могут возникать некоторые ковалентные связи. Сила сцепления кристальная.
Классификация металлов
Металлическая структура характеризуется энтальпией атомизации, а край колеблется от 61,4 кДж / рт. Моль до 850 кДж / Вт моль. Энтальпия атомизации характерна для металлов серий Nb-Ru и Hf-Ir. Родственные металлы отличаются максимумом. Плавкость меха на прочность.
- Классификация металлов: Все металлы — это s-металл (все s-элементы, кроме H и He), p-металл (элементы группы IIIa, кроме B, и Sn, Рb, Sb, Bi, Po), d -металлы, f-металлы, они объединены под своими именами. «Переходный» (см. Переходные элементы). Первые две группы металлов иногда называют. «Простой».
Некоторые более узкие группы отличаются от этих групп: элементы s-металл-щелочной металл и щелочноземельный металл и d-металл-платина. В группу редкоземельных элементов входят как d, так и f металлы (подгруппы Sc и лантаноиды).
Есть также технологии, которые не являются общепринятыми. Классификация металлов. В определенной степени это отражает геохимическую классификацию элементов. Обычно отмечают след.
Группа: цветные металлы (Fe), тяжелые цветные металлы -Cu, Pb, Zn, Ni и Sn, легкие металлы (плотность менее 5 г / см3) -Al, Mg, Ca и др. Благородные металлы — Au, Ag, платиновые металлы, легированные (или ферросплавные) металлы — Mn, Cr, W, Mo, Nb, V и т. Д. Редкие металлы (см. Редкие элементы) разбиваются на несколько по порядку. Группа; Радиоактивные металлы-U, Th, Pu и др.
Кристаллическая структура: большинство металлов кристаллизуется в одном из трех типов структуры (см. Металлические кристаллы): кубы. И шестиугольники. Плотная упаковка (см. Плотная упаковка) или объемно-ориентированный куб. Бар.
В наиболее плотном пакете каждый атом имеет 12 ближайших соседей на равных расстояниях. Объемно-центрированный куб. Каждый атом имеет восемь равноотстоящих соседей, а остальные шесть соседей расположены на больших (15%) расстояниях. Так что координируйте. Номер этой структуры считается равным 14 (8 + 6). Межатомное расстояние кристалла. Металлическая структура характеризуется металлом. Радиус.
Кристаллическая структура
В нормальных условиях щелочные металлы и элементы Ba, Ra, подгруппы V и Cr кристаллизуются в объемно-центрированных кубах. решетка типа a-Fe. Самый плотный куб.
- Упаковка типа C (гранецентрированная кубическая решетка) характерна для Al, Ni, металлов подгруппы Cu, платиновых металлов (исключая Ru и Os). В наиболее плотной упаковке типа Mg кристаллизуются Be, Ca, Sr, Zn, Cd, Co, Ru и Os, а элементы подгруппы Ti и Sc, pl. РЗЭ. Более сложной является структура разложения. Модификация Mn, Ra, U и трансурановых элементов.
Многие металлы претерпевают полиморфные превращения при изменении температуры или давления. Например, низкий t-ra металл образует плотную упаковку. Ca, La и Zr часто имеют объемно-центрированные кубические высокотемпературные модификации. Структура.
При расплавлении металл удерживается электрически, термически и оптически. УО. Вблизи точки плавления жидкого металла наблюдается ближний порядок, почти такой же, как у кристаллического металла. При повышении температуры ближний порядок нарушается до тех пор, пока он не станет полностью беспорядочным.
Физические свойства
Физические свойства св-ва металл варьируется в очень широком диапазоне. Поэтому температура плавления варьируется от -38,87 ° С (Hg) до 3380 ° С (Вт), плотность от -0,531 г / см3 (Li) до 22,5 г / см3 (Os). Сопротивление Beat Electric p при 25 ° C составляет от 1,63 (Ag) до 140 (Mn) мкОм.с. Сопротивление движению электронов (рассеяние электронов) обусловлено нарушением кристалличности.
Решетка и дефекты (вакансии, дислокации, примесные атомы) обусловлены тепловым движением атомов. Мера — это длина свободы. Поток электронов. При комнатной температуре она составляет ~ 10-6 см для металлов нормальной чистоты и ~ 10-2 см для металлов высокой чистоты.
Температурный коэффициент p (диапазон 0-100 ° C) изменяется в диапазоне 1,0,10-3 (Hg) -9,0,10-3 K-1 (Be). В гелиевых m-ts (4,2 К) p практически не зависит от t-pes. Измерения используются для характеристики чистоты и целостности металлического кристалла. Чем больше соотношение r273 / r4,2, тем чище металл. Для монокристаллов высокой чистоты он достигает 104-105. Некоторые металлы с низким m-ts становятся сверхпроводниками, что очень важно. 1/100 К чистого металла
Для металлов наблюдается термоэлектронная эмиссия (способность испускать электроны при высоких значениях t-pe). Эмиссия электронов происходит даже под воздействием электромагнита. Излучение в видимой и ультрафиолетовой области спектра (фотоэмиссия).
| Реферат на тему | На заказ | Образец и пример |
| Металлическая связь и структура металлов | Металлические связи происходят между атомами металла. | Металлические связи ненасыщены из-за небольшого числа электронов на внешних энергетических уровнях, которые слабо удерживаются ядром, и большого количества свободных атомных орбиталей, близких по энергии. |
Поле высокой напряженности (туннелирование или полевая эмиссия) при бомбардировке металлов электронами (вторичная электронная эмиссия) или ионами (ионная эмиссия электронов) в электрических взаимодействиях Поверхность металла с плазмой (взрывная эмиссия электронов). Электричество появляется в металле из-за разницы температур. Ток (тепловая мощность).
Теплопроводность металлов в основном обусловлена движением электронов, т.е. биениями. Коэффициенты теплопроводности () и электропроводности металла взаимосвязаны соотношением / (с • Т) = L = 2,45 • 10 -8 Вт • Ом / К2 (закон Видемана-Франца). Коэффициенты теплопроводности металлов имеют значения теплопроводности от 425 (для Ag) до 8,41 (для Bi) Вт / (мК).
| Строение и свойства двойных металлических систем. | Определение механических свойств по твердости. |
| Фазовые и структурные превращения в титановых сплавах. | Развитие науки о резании металлов. |
